题目内容
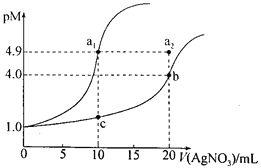
【题目】密闭容器中盛有1 mol PCl5,加热到200℃时发生了反应:PCl5(g) ![]() PCl3(g)+Cl2(g),反应达到平衡时PCl5的分解率为M%,若在同一温度和同样容器中最初投入的是2 mol PCl5,反应达到平衡时PCl5的分解率为N%。M与N的关系是( )
PCl3(g)+Cl2(g),反应达到平衡时PCl5的分解率为M%,若在同一温度和同样容器中最初投入的是2 mol PCl5,反应达到平衡时PCl5的分解率为N%。M与N的关系是( )
A. M>N B. M<N C. M=N D. 无法确定
【答案】A
【解析】
开始加入2 mol PCl5所到达的平衡,可以等效为先将体积增大1倍到达的平衡状态,该状态与开始加入1 mol PCl5是完全相同的平衡状态,然后在将体积压缩恢复到原来的体积,增大压强平衡向体积减小的方向移动,据此判断。
开始加入2mol PCl5所到达的平衡,可以等效为先将体积增大1倍到达的平衡状态,该状态与开始加入1 mol PCl5是完全相同的平衡状态,然后在将体积压缩恢复到原来的体积,增大压强平衡向体积减小的方向移动,即平衡向逆反应方向移动, PCl5的分解率减小,故M%> N%,所以A选项是正确;
综上所述,本题选A。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
【题目】自催化作用是指反应物之一使该 反应速率加快的作用。用稀硫酸酸化的![]() 进行下列三组实验,一段时间后溶液均褪色(
进行下列三组实验,一段时间后溶液均褪色(![]() 可以记做
可以记做![]() )。
)。
实验① | 实验② | 实验③ |
|
|
|
褪色 | 比实验①褪色快 | 比实验①褪色快 |
下列说法不正确的是
A.实验①中发生氧化还原反应,![]() 是还原剂,产物MnSO4能起自催化作用
是还原剂,产物MnSO4能起自催化作用
B.实验②褪色比①快,是因为MnSO4的催化作用加快了反应速率
C.实验③褪色比①快,是因为Cl-的催化作用加快了反应速率
D.若用![]() 的
的![]() 做实验①,推测比实验①褪色快
做实验①,推测比实验①褪色快