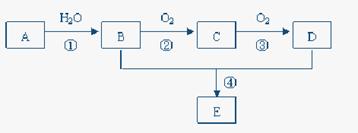
题目内容
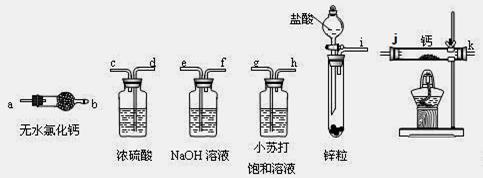
利用如图装置探究氯气和氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为较纯净干燥的氯气与氨气反应的装置。
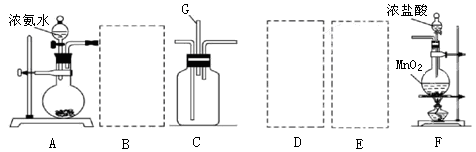
请回答下列问题:
(1)装置F中发生反应的离子方程式为 。
(2)装置A中的烧瓶内固体宜选用 (选填以下选项的代号)
A.碱石灰 B.生石灰 C.二氧化硅 D.五氧化二磷 E.烧碱
(3)按A接B接C;F接E接D接C,请在各虚线框内画上合适的装置图并注明所装试剂名称:

(4)在C中观察到大量白烟,同时产生一种气体单质,该反应的化学方程式为 ,反应中氧化剂与还原剂的物质的量比为 。设计一个实验方案鉴定该固体是氯化铵(要求写出操作、现象及结论): 。
(5)从装置C的G处逸出的尾气可能含有污染环境的气体,如何处理:

请回答下列问题:
(1)装置F中发生反应的离子方程式为 。
(2)装置A中的烧瓶内固体宜选用 (选填以下选项的代号)
A.碱石灰 B.生石灰 C.二氧化硅 D.五氧化二磷 E.烧碱
(3)按A接B接C;F接E接D接C,请在各虚线框内画上合适的装置图并注明所装试剂名称:

(4)在C中观察到大量白烟,同时产生一种气体单质,该反应的化学方程式为 ,反应中氧化剂与还原剂的物质的量比为 。设计一个实验方案鉴定该固体是氯化铵(要求写出操作、现象及结论): 。
(5)从装置C的G处逸出的尾气可能含有污染环境的气体,如何处理:
(15分)(1)MnO2+4H++2Cl- Mn2++Cl2↑+2H2O (2分)(2)ABE (3分)
Mn2++Cl2↑+2H2O (2分)(2)ABE (3分)
(3)(见右图)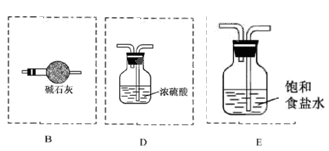 (3分)
(3分)
(4)3Cl2+8NH3=6NH4Cl+N2;3∶2 (各2分);取适量该白色固体与浓氢氧化钠溶液共热,产生能使湿润的红色石蕊试纸变蓝的无色气体;另取适量该白色固体,溶于水后加入硝酸银溶液,产生不溶于硝酸的白色沉淀 (2分)
(5)将尾气通过一倒置的漏斗通入盛有NaOH溶液的烧杯中(1分)
 Mn2++Cl2↑+2H2O (2分)(2)ABE (3分)
Mn2++Cl2↑+2H2O (2分)(2)ABE (3分)(3)(见右图)
 (3分)
(3分)(4)3Cl2+8NH3=6NH4Cl+N2;3∶2 (各2分);取适量该白色固体与浓氢氧化钠溶液共热,产生能使湿润的红色石蕊试纸变蓝的无色气体;另取适量该白色固体,溶于水后加入硝酸银溶液,产生不溶于硝酸的白色沉淀 (2分)
(5)将尾气通过一倒置的漏斗通入盛有NaOH溶液的烧杯中(1分)
试题分析:(1)F装置是制备氯气的,浓盐酸和二氧化锰在加热条件下反应生成氯化锰、氯气和水,反应的离子方程式是MnO2+4H++2Cl-
 Mn2++Cl2↑+2H2O。
Mn2++Cl2↑+2H2O。(2)装置A是制备氨气的,氨水中存在电离平衡NH3·H2O
 NH4++OH-,碱石灰、生石灰和烧碱溶于水放出热量,且增大溶液中OH-的浓度,促使平衡向逆反应方向移动 进而放出氨气。二氧化硅不溶于水,五氧化二磷虽然溶于水时放热,但溶液显酸性,得不到氨气。因此正确的答案选A、B、E。
NH4++OH-,碱石灰、生石灰和烧碱溶于水放出热量,且增大溶液中OH-的浓度,促使平衡向逆反应方向移动 进而放出氨气。二氧化硅不溶于水,五氧化二磷虽然溶于水时放热,但溶液显酸性,得不到氨气。因此正确的答案选A、B、E。(3)氨气中混有水蒸气,氨气是碱性气体,要除去水蒸气只能用碱性物质;制取的氯气中混有氯化氢气体和水蒸气,氯化氢极易溶于水,氯气也能溶于水,所以不能用水除去氯化氢气体;氯气和水反应生成盐酸和次氯酸,食盐水中含有氯离子,能抑制氯气的溶解,所以要想除去氯气中的氯化氢应该选择饱和食盐水;水蒸气常用浓硫酸除去,因此正确的连接是
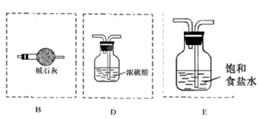 。
。(4)在C中观察到大量白烟,同时产生一种气体单质,白烟应该是氯化铵,单质应该是氮气。这说明氯气和氨气在常温下混合就能发生反应生成氯化铵和氮气,反应的化学方程式是8NH3+3C12=6NH4C1+N2;根据方程式可知,氮元素的化合价从-3价升高到0价,氯元素的化合价从0价降低到-1价,所以根据电子的得失守恒可知,反应中氧化剂与还原剂的物质的量比为3∶2;氯化铵中含有氯离子和铵根离子,氯离子用硝酸酸化的硝酸银溶液检验;氨气用紫色石蕊试纸检验;检验方法为:将固体在烧杯中溶解,用试管取少量溶液,然后滴加少量硝酸酸化的AgNO3溶液,有白色沉淀产生,证明有C1-;用试管取少量溶液,加入浓烧碱溶液,加热,再将湿润的红色石蕊试纸放在试管口,红色石蕊试纸变蓝证明有NH4+。
(5)氯气属于大气污染物,需要尾气处理,正确的的操作应该是将尾气通过一倒置的漏斗通入盛有NaOH溶液的烧杯中。

练习册系列答案
 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目


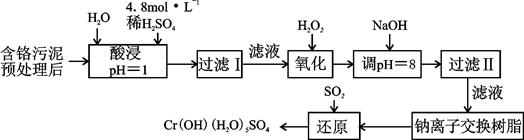
 Cr3+(aq)+3OH-(aq)
Cr3+(aq)+3OH-(aq) 的溶度积Ksp= c(Cr3+)? c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至 。
的溶度积Ksp= c(Cr3+)? c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至 。