题目内容
【题目】Ⅰ:Mo基催化剂的耐硫甲烷化反应会涉及WGS 或者RWGS 反应,主要反应式如下:
(1)CO和CO2甲烷化 CO(g)+3H2(g)=CH4(g)+H2O(g) ΔH1=-206.2kJ/mol
CO2(g)+4H2(g)=CH4(g)+2H2O(g) ΔH2=-165.0kJ/mol
写出CO 与水蒸气反应生成CO2和H2的热化学方程式__________________________________。
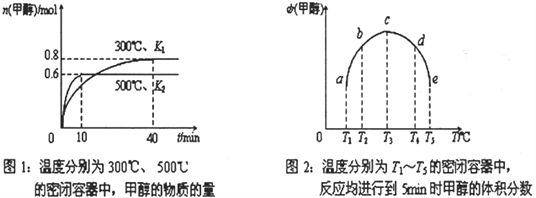
(2)CO和H2在一定条件下合成甲醇的反应为:CO(g)+2H2(g)![]() CH3OH(g) ΔH。现在容积均为1L 的a、b、c、d、e 五个密闭容器中分别充入1molCO和2molH2的混合气体,控温,进行实验,测得相关数据如下图1和图2。
CH3OH(g) ΔH。现在容积均为1L 的a、b、c、d、e 五个密闭容器中分别充入1molCO和2molH2的混合气体,控温,进行实验,测得相关数据如下图1和图2。
 ,
,
①该反应的ΔH__________0 (选填“<”、“>”或“=”)。
②在500℃条件下达平衡时CO 的转化率为______________________。
③计算在300℃条件下达平衡时K=________________________。
④将容器d 中的平衡状态转变到容器c中的平衡状态,可采取的措施有______________________。
Ⅱ:某电解装置如图所示,X、Y 均为惰性电极:
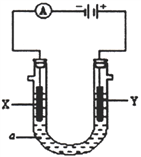
(3)若a溶液为滴有酚酞试液的NaNO3溶液,通电一段时间后X 电极及周围溶液的现象是:________________________________,Y 电极的电极反应式为______________________。
(4)若a 溶液为饱和CuCl2溶液,当电路中有0.2 mol 的电子通过时,阴、阳两电极的质量之差是__________g。
【答案】 CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=-41.2kJ/mol < 60% 25(mol/L)-2 降低温度或者增大压强 溶液变红、X电极上有气泡产生 2H2O-4e-=O2↑+4H+(或4OH--4e-=O2↑+2H2O) 6.4g
【解析】(1)①CO和CO2甲烷化 CO(g)+3H2(g)=CH4(g)+H2O(g) ΔH1=-206.2kJ/mol,②CO2(g)+4H2(g)=CH4(g)+2H2O(g) ΔH2=-165.0kJ/mol由盖斯定律①-②,CO 与水蒸气反应生成CO2和H2的热化学方程式CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=-41.2kJ/mol;(2)CO(g)+2H2(g)![]() CH3OH(g) 由图1,升高温度,甲醇减少,平衡逆向移动,该反应的ΔH<0;(2) CO(g)+2H2(g)
CH3OH(g) 由图1,升高温度,甲醇减少,平衡逆向移动,该反应的ΔH<0;(2) CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
n始/mol 1 2
n变/mol 0.6 1.2 0.6
n平/mol 0.4 0.8 0.6
②在500℃条件下达平衡时CO 的转化率为0.6/1×100%=60%;
③ CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
n始/mol·L-1 1 2
n变/mol·L-1 0.8 1.6 0.8
n平/mol·L-1 0.2 0.4 0.8
计算在300℃条件下达平衡时K=![]() =25(mol/L)-2;④将容器d 中的平衡状态转变到容器c中的平衡状态,可采取的措施有降低温度或者增大压强;(3)若a溶液为滴有酚酞试液的NaNO3溶液,X为阴极,氢离子得电子后生成氢气,破坏水电离平衡,产生氢氧根,通电一段时间后X 电极及周围溶液的现象是:溶液变红、X电极上有气泡产生,阳极是Y,Y 电极的电极反应式为 2H2O-4e-=O2↑+4H+(或4OH--4e-=O2↑+2H2O);(4)若a 溶液为饱和CuCl2溶液,当电路中有0.2 mol 的电子通过时,阴极有0.2mol/2×64g·mol-1=0.64g铜析出,阳极产生氯气,两电极的质量之差是0.64g。
=25(mol/L)-2;④将容器d 中的平衡状态转变到容器c中的平衡状态,可采取的措施有降低温度或者增大压强;(3)若a溶液为滴有酚酞试液的NaNO3溶液,X为阴极,氢离子得电子后生成氢气,破坏水电离平衡,产生氢氧根,通电一段时间后X 电极及周围溶液的现象是:溶液变红、X电极上有气泡产生,阳极是Y,Y 电极的电极反应式为 2H2O-4e-=O2↑+4H+(或4OH--4e-=O2↑+2H2O);(4)若a 溶液为饱和CuCl2溶液,当电路中有0.2 mol 的电子通过时,阴极有0.2mol/2×64g·mol-1=0.64g铜析出,阳极产生氯气,两电极的质量之差是0.64g。

 星级口算天天练系列答案
星级口算天天练系列答案【题目】一种通过铁基氧载体(Fe3O4/FeO)深度还原和再生来合成二甲醚(CH3OCH3)的原理如下图:

(1)二甲醚的合成反应:3CO(g)+3H2(g) ![]() CH3OCH3(g)+CO2(g) ΔH1
CH3OCH3(g)+CO2(g) ΔH1
①已知CO、H2与CH3OCH的燃烧热(ΔH)分别为a kJ·mol-1、b kJ·mol-1、c kJ·mol-1、(a、b、c均小于0),则ΔH1=________kJ·mol-1。
②该反应选用CuO/ZnO/Al2O3复合催化剂,该催化剂能_______(填标号)。
A.促进平衡正向移动 B.提高反应速率
C.降低反应的活化能 D.改变反应的焓变
(2)CH4氧化器中发生的主反应:
ⅰ. CH4(g)+Fe3O4(s)![]() CO(g)+2H2(g)+3Fe(s)
CO(g)+2H2(g)+3Fe(s)
ⅱ. CH4(g)+4Fe3O4(s)![]() CO2(g)+2H2O(g)+12FeO(s)
CO2(g)+2H2O(g)+12FeO(s)
850℃时,压强和部分气体体积分数、固相各组分质量分数的关系如下图。

①随着压强的增大,反应ⅰ的平衡常数K值________(填“增大”、“减小”、 或“不变”)
②结合图像,分析H2O的体积分数变化的原因_________(用化学方程式表示)
(3)将一定量的FeO和CO2置于CO2还原器(体积不变的密闭容器)中,发生的主反应:
CO2(g)+3FeO(s)![]() Fe3O4(s)+ CO (g) ΔH2
Fe3O4(s)+ CO (g) ΔH2
保持其他条件不变,测得不同温度下最终反应体系中CO、CO2体积分数如下表:
温度I/℃ | 100 | 170 | 200 | 300 | 400 | 500 |
CO2体积分数 | 0.67 | 0.67 | 0.75 | 0.82 | 0.9 | 0.92 |
CO体积分数 | 0.33 | 0.33 | 0.25 | 0.18 | 0.1 | 0.08 |
①ΔH2_______0(填“>”或“<”)。
②若在150℃时进行上述转化,理论转化率ɑ(FeO)=___________。
③在上述反应体系中,一定可以说明该反应达到平衡状态的是______(填标号)。
A.体系的压强不变 B.CO2的物质的量不变
C.CO的生成速率和消耗速率相等且不等于零 D.气体的平均摩尔质量不变
④根据化学反应原理,分析CO2还原器温度设置在170℃的原因___________。