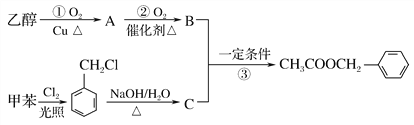
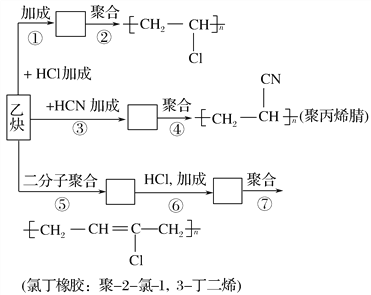
题目内容
【题目】电解Na2SO3溶液,可再生NaOH,同时得到H2SO4,其原理如图所示(电极材料为石墨)。下列说法正确的是

A. 电解过程中若消耗12.6gNa2SO3,则阴极区变化的质量为4.4g (假设该过程中所有液体进出口密闭)
B. b放电的电极反应式为SO32-+H2O-e-= SO42-+2H+
C. 电子由a经内电路流向b电极
D. 图中b极连接电源的正极,C 口流出的物质是亚硫酸
【答案】A
【解析】A、图中可知,钠离子移向a极,亚硫酸根离子移向b极,所以b极为阳极,应该接电源的正极,SO32-在阳极失去电子变成SO42-,电极反应式为SO32-+H2O-2e-= SO42-+2H+,所以C口流出的物质是H2SO4。a电极是阴极,氢离子放电,2H++2e-=H2↑,B口流出氢氧化钠。电解过程中若消耗12.6gNa2SO3,即0.1mol亚硫酸钠,则阴极区消耗0.2mol氢离子,有0.2mol氢钠离子移向阴极区,所以变化的质量为4.6g-0.2g=4.4g (假设该过程中所有液体进出口密闭),A正确;B、b放电的电极反应式为SO32-+H2O-2e-= SO42-+2H+,B错误;C. 电子由b经外电路流向a电极,C错误;D. 图中b极连接电源的正极,C 口流出的物质是硫酸,D错误,答案选A。

练习册系列答案
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案
相关题目