题目内容
(14分)某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。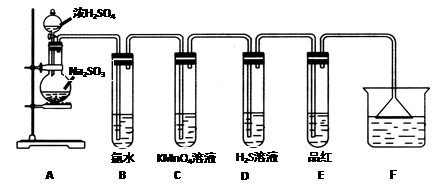
请回答下列问题:
(1)装置A中盛放浓硫酸和亚硫酸钠的仪器名称分别是 、 ;
(2)反应后,装置B中发生的现象是 ,反应的离子方程式为 ;装置C中的现象是 ,表现了SO2的 ;装置D中现象是 ,发生反应的化学方程式为 ;
(3)装置E的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象 。
(4)F装置的作用是 ,漏斗的作用是 。
(14分)(1)分液漏斗、圆底烧瓶
(2)溶液褪色,SO2+Cl2+2H2O = 4H++2Cl-+SO42-;
溶液紫色褪去(溶液褪色),还原性;
有黄色沉淀生成,2H2S+SO2=3S+2H2O
(3)将试管E在酒精灯上加热,溶液恢复红色;
(4)吸收多余的SO2,防止倒吸。
解析试题分析:本实验的目的是探究二氧化硫的性质,A装置是制备二氧化硫,用圆底烧瓶和分液漏斗分别盛放固体及液体;B装置是验证二氧化硫的还原性,与氯气反应生成盐酸和硫酸,现象会溶液褪色,离子方程式为SO2+Cl2+2H2O = 4H++2Cl-+SO42-;C装置也是验证二氧化硫的还原性,紫色褪去,说明发生反应;D装置是检验二氧化硫的氧化性,有黄色沉淀生成,说明发生反应2H2S+SO2=3S+2H2O;E装置是检验二氧化硫的漂白性,为了检验漂白的暂时性,将试管E在酒精灯上加热,溶液恢复红色;F装置是用氢氧化钠吸收多余的SO2,加倒置的漏斗主要是防止倒吸。
考点:考查二氧化硫的性质及常见的实验仪器及组合装置的作用。
点评:只要掌握二氧化硫的化学性质,对组合装置的作用了解清楚,本题不是很难。

 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案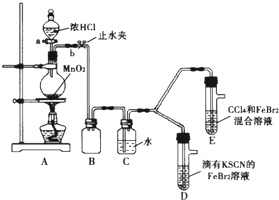 某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:
某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:(1)①连接仪器:把玻璃导管插入橡胶塞的操作是:
②检查气体发生装置A的气密性的操作是:向分液漏斗中注水,若水不能顺利流下,则气密性良好.
(2)整套实验装置存在一处明显不足,请指出
用改正后的装置进行实验.实验过程如下:
| 实验操作 | 实验现象 | 结论 |
| 打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯 | D装置中:溶液变红 E装置中:水层溶液变黄 振荡后CCl4层无明显变化 |
Cl2、Br2、Fe3+的氧化性由强到弱的顺序为: |
D装置中:红色慢慢褪去.
E装置中:CCl4层先由无色变为橙色,后颜色逐渐变成红色.
为探究上述实验现象的本质,小组同学查得资料如下:
| Ⅰ.(SCN)2性质与卤素单质类似.氧化性:Cl2>(SCN)2. Ⅱ.Cl2和Br2反应生成BrCl,它呈红色(略带黄色),沸点为5℃,与水发生水解反应. Ⅲ.AgClO、AgBrO均可溶于水. |
②欲探究E中颜色变化的原因,设计实验如下:用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生.请结合化学用语解释仅产生白色沉淀的原因
 某化学兴趣小组为探究铜跟浓硫酸的反应,如图所示装置进行有关实验.
某化学兴趣小组为探究铜跟浓硫酸的反应,如图所示装置进行有关实验.
 某化学兴趣小组为探究SO2的性质,按如图所示装置进行实验.
某化学兴趣小组为探究SO2的性质,按如图所示装置进行实验.

