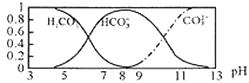
题目内容
【题目】100mL某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32﹣、SO42﹣、NO3﹣中的几种.①若加入锌粒,会产生H2;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.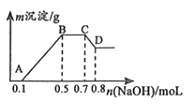
则:
(1)溶液中一定含有的阳离子有 , 一定不含有的离子有 .
(2)C→D的离子方程式为 .
(3)由A→B及C→D段有关数据可计算出的某两种离子的物质的量浓度分别为molL﹣1和molL﹣1 .
【答案】
(1)H+、NH4+、Mg2+、Al3+;CO32﹣、NO3﹣、Fe3+
(2)Al(OH)3+OH﹣=AlO2﹣+2H2O
(3)1;0.5
【解析】根据①可知,溶液显酸性,则溶液中一定不存在CO32﹣和NO3﹣;根据②可知,产生的是白色沉淀,说明不存在Fe3+;根据产生的沉淀量与加入NaOH的物质的量之间的关系图可知,溶液中一定含有Mg2+、Al3+;又因为当沉淀达到最大值时,继续加入氢氧化钠,沉淀不变,这说明溶液中还存在NH4+ , 根据溶液电中性可知,溶液中一定存在阴离子SO42﹣;即一定含有:H+、NH4+、Mg2+、Al3+、SO42﹣ , 一定不含CO32﹣、NO3﹣、Fe3+ . (1)溶液中一定含有的阳离子有H+、NH4+、Mg2+、Al3+; 一定不含有的离子有CO32﹣、NO3﹣、Fe3+;故答案为:H+、NH4+、Mg2+、Al3+;CO32﹣、NO3﹣、Fe3+;
(2)C→D的反应为氢氧化铝溶于氢氧化钠,其离子方程式为Al(OH)3+OH﹣=AlO2﹣+2H2O;故答案为:Al(OH)3+OH﹣=AlO2﹣+2H2O;
(3)根据图像可知,A→B为Mg2+、Al3+与氢氧化钠反应,消耗氢氧化钠为0.5mol﹣0.1mol=0.4mol,C→D阶段为氢氧化钠溶解氢氧化铝:Al(OH)3+OH﹣=AlO2﹣+2H2O,消耗氢氧化钠0.8mol﹣0.7mol=0.1mol,则n[Al(OH)3]=0.1mol,根据铝元素守恒可知n(Al3+)=0.1mol;则c(Al3+)= ![]() =1mol/L;与镁离子反应的氢氧化钠为0.4mol﹣0.1mol×3=0.1mol,则n[Mg(OH)2]=0.05mol,则则c(Mg2+)=
=1mol/L;与镁离子反应的氢氧化钠为0.4mol﹣0.1mol×3=0.1mol,则n[Mg(OH)2]=0.05mol,则则c(Mg2+)= ![]() =0.5mol/L;故答案为:1;0.5根据①可知,溶液显酸性,则溶液中一定不存在CO32﹣和NO3﹣;根据②可知,产生的是白色沉淀,说明不存在Fe3+;根据产生的沉淀量与加入NaOH的物质的量之间的关系图可知,溶液中一定含有Mg2+、Al3+;又因为当沉淀达到最大值时,继续加入氢氧化钠,沉淀不变,这说明溶液中还存在NH4+ , 根据溶液电中性可知,溶液中一定存在阴离子SO42﹣;即一定含有:H+、NH4+、Mg2+、Al3+、SO42﹣ , 一定不含CO32﹣、NO3﹣、Fe3+ , 据此解答即可.
=0.5mol/L;故答案为:1;0.5根据①可知,溶液显酸性,则溶液中一定不存在CO32﹣和NO3﹣;根据②可知,产生的是白色沉淀,说明不存在Fe3+;根据产生的沉淀量与加入NaOH的物质的量之间的关系图可知,溶液中一定含有Mg2+、Al3+;又因为当沉淀达到最大值时,继续加入氢氧化钠,沉淀不变,这说明溶液中还存在NH4+ , 根据溶液电中性可知,溶液中一定存在阴离子SO42﹣;即一定含有:H+、NH4+、Mg2+、Al3+、SO42﹣ , 一定不含CO32﹣、NO3﹣、Fe3+ , 据此解答即可.

【题目】已知反应X(g)+Y(g) ![]() R(g)+Q(g)的平衡常数与温度的关系如表.830℃时,向一个2 L的密闭容器中充入0.2 mol X和0.8 mol Y,反应初始4 s内v(X)=0.005mol/(Ls).下列说法正确的是( )
R(g)+Q(g)的平衡常数与温度的关系如表.830℃时,向一个2 L的密闭容器中充入0.2 mol X和0.8 mol Y,反应初始4 s内v(X)=0.005mol/(Ls).下列说法正确的是( )
温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
A.4s时容器内c(Y)=0.76 mol/L
B.830℃达平衡时,X的转化率为80%
C.反应达平衡后,升高温度,平衡正向移动
D.1200℃时反应R(g)+Q(g) ![]() X(g)+Y(g)的平衡常数K=0.4
X(g)+Y(g)的平衡常数K=0.4