题目内容
【题目】(1)从海水中可提取多种化工原料,下面是工业上对海水的几项综合利用的示意图。

Ⅰ.海水所得粗盐中含Ca2+、Mg2+、SO![]() - 等杂质,为了有效除去Ca2+、Mg2+、SO
- 等杂质,为了有效除去Ca2+、Mg2+、SO![]() -,加入试剂的合理顺序为___________。
-,加入试剂的合理顺序为___________。
A.先加NaOH,后加Na2CO3,再加Ba2+试剂
B.先加NaOH,后加Ba2+试剂,再加Na2CO3
C.先加Ba2+试剂,后加NaOH,再加Na2CO3
要除去SO![]() -,必须添加钡试剂,该钡试剂可以是___________。
-,必须添加钡试剂,该钡试剂可以是___________。
A.Ba(OH)2 B. Ba(NO3)2 C.BaCl2
Ⅱ.写出用Ca(OH)2制取氢氧化镁的化学方程式:_____________________。
从经济效益角度看,该化工厂的厂址应选择在__________________。
(2)海藻中提取碘的流程如图:
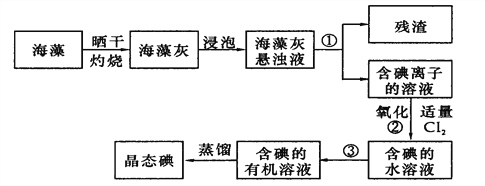
指出提取碘的过程中有关实验操作名称:①__________,③__________;
写出过程②中有关反应的离子方程式____________________________。
【答案】BCACMgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2海边过滤萃取分液Cl2+2I-=I2+2Cl-
【解析】
(1)I.有效除去Ca2+、Mg2+、SO42-,应注意碳酸钠在钡试剂之后,是为除去过量的钡离子,显然选项BC符合,故答案为BC;
要除去SO![]() -,必须添加钡试剂,同时考虑不引入杂质离子,该钡试剂可以是Ba(OH)2 和BaCl2,不能用Ba(NO3)2 ,因为引入的NO3-无法除去,故答案为AC;
-,必须添加钡试剂,同时考虑不引入杂质离子,该钡试剂可以是Ba(OH)2 和BaCl2,不能用Ba(NO3)2 ,因为引入的NO3-无法除去,故答案为AC;
Ⅱ.海水中的MgCl2与加入的Ca(OH)2反应可得到氢氧化镁,反应的化学方程式为MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2;从经济效益角度看,该化工厂的厂址应选择在海边,可直接利用海水,减少运输成本;
(2)分离固体和液体用过滤,利用溶质在互不相溶的溶剂里溶解度不同,用一种溶剂把溶质从它跟另一种溶剂所组成的溶液里提取出来,这种方法叫做萃取,③将碘水中的碘单质萃取出来,互不相溶的物质的分离是分液法;过程②用氯气氧化I-生成I2,发生反应的离子方程式为 Cl2+2I-=I2+2Cl-。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案