题目内容
现有反应:CO(g)+H2O(g)?CO2(g)+H2(g),已知1mol CO和2mol H2O(g)在一定条件下反应达平衡时生成0.7mol CO2,若其它条件不变,把2mol H2O(g)改成4mol,达平衡时生成CO2可能是( )
| A、1.2 mol |
| B、0.83 mol |
| C、1.5 mol |
| D、2 mol |
考点:化学平衡的计算
专题:化学平衡专题
分析:若其他条件不变,一开始就加入4mol H2O(g),相当于在原平衡的基础上加入2molH2O(g),平衡向正反应方向移动,但不能完全反应,再根据极限法进行判断.
解答:
解:若其他条件不变,一开始就加入4mol H2O(g),相当于在原平衡的基础上加入2molH2O(g),平衡向正反应方向移动,CO的转化率增大,故平衡时CO2的物质的量大于0.7mol,由于可逆反应不能进行完全,因此1molCO不可能完全转化,生成CO2的物质的量小于1mol,故平衡时0.7mol<n(CO2)<1mol,
故选:B.
故选:B.
点评:本题考查化学平衡移动与计算、可能反应的特点等,难度不大,注意构建平衡建立的途径利用极限法进行解答.

练习册系列答案
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案
相关题目
一定条件下存在反应:A(g)+B(g)?C(g)+D(g)△H<0.现有三个相同的2L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1mol A和1mol B,在Ⅱ中充入1mol C和1mol D,在Ⅲ中充入2mol A和2mol B,500℃条件下开始反应.达到平衡时,下列说法正确的是( )
| A、容器Ⅰ、Ⅱ中正反应速率相同 |
| B、容器Ⅰ、Ⅲ中反应的平衡常数相同 |
| C、容器Ⅰ中A的物质的量比容器Ⅱ中的多 |
| D、容器Ⅰ中A的转化率与容器Ⅱ中C的转化率之和小于1 |
下列关于钠、镁、铝性质说法正确的是( )
| A、铝的金属性最强 |
| B、镁的原子半径最大 |
| C、它们的最高价氧化物的水化物中,只有NaOH属于强碱 |
| D、铝的最高价是+3价,最低价是-5价 |
下列说法正确的是( )
| A、第ⅠA族的金属单质与水反应一定比第ⅡA族的金属单质剧烈 |
| B、第二周期元素的最高正价和最低负价的绝对值之和等于8 |
| C、同周期主族元素的原子形成简单离子的电子层结构相同 |
| D、第ⅥA族元素的氢化物中,稳定性最好的其沸点也最高 |
长周期元素周期表共有18个纵行,从左到右排为1~18列,即碱金属是第一列,稀有气体是第18列.按这种规定,下面说法不正确的是( )
| A、第9列元素中没有非金属 |
| B、第15列元素的原子最外层电子的排布是ns2np3 |
| C、最外层电子排布为ns2的元素都在第2列 |
| D、第10、11列元素分别处在d区和ds区 |
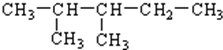

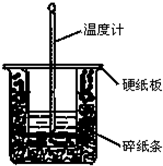 50mL 0.50mol?L-1盐酸与50mL 0.55mol?L-1NaOH溶液在图示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL 0.50mol?L-1盐酸与50mL 0.55mol?L-1NaOH溶液在图示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: