题目内容
8. 有下列化合物:①NH4Al(SO4)2、②NH4HSO4、③NH4Cl、④NH3•H2O、⑤CH3COONH4,回答下列问题.
有下列化合物:①NH4Al(SO4)2、②NH4HSO4、③NH4Cl、④NH3•H2O、⑤CH3COONH4,回答下列问题.(1)等浓度的以上化合物溶液中NH${\;}_{4}^{+}$浓度由大到小的顺序是②①③⑤④.(用序号表示)
(2)将浓度都为0.1mol•L-1的③和④混合,关于所得溶液下列说法正确的是ABE
A、如果溶液显酸性,则c(C1ˉ)>c(NH4+)>c(H+)>c(OHˉ)
B、如果c(C1ˉ)=c(NH4+),则溶液显中性
C、其浓度大小可能为:c(C1ˉ)>c(NH4+)>c(OHˉ)>c(H+)
D、如果③和④等体积混合,则所得溶液满足关系:
c(NH4+)+c(NH3•H2O)=0.2mol•L-1
E、所得溶液肯定满足关系:c(C1ˉ)+c(OHˉ)=c(NH4+)+c(H+)
(3)NH4Al(SO4)2可作净水剂,其理由是Al3++3HCO3-=Al(OH)3↓+3CO2↑Al3+水解生成的Al(OH)3胶体具有吸附性,Al3++3H2O?Al(OH)3(胶体)+3H+,Al(OH)3胶体吸附悬浮颗粒使其沉降从而净化水(用必要的化学用语和相关文字说明).向NH4Al(SO4)2溶液中加入小苏打溶液后产生气泡和白色沉淀,其原因是Al3++3HCO3-=Al(OH)3↓+3CO2↑.(写离子方程式即可)
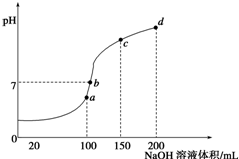
(4)室温时,向100mL 0.1mol•L-1NH4HSO4溶液中滴加0.1mol•L-1NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示.试分析图中a、b、c、d四个点,水的电离程度最大的是a;在b点,溶液中各离子浓度由大到小的排列顺序是c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+).
分析 (1)直接电离出的铵根离子越多,铵根浓度越大,电离出的铵根离子一样多,铵根离子的水解程度越大,铵根离子浓度越小;
(2)浓度相等的氨水和氯化铵混合,溶液显示碱性,氨水的电离程度大于铵根离子的水解程度,根据溶液中的守恒来回答;
(3)Al3+水解生成的Al(OH)3胶体具有吸附性,能净水;铝离子和碳酸氢根离子之间发生双水解反应可以得到氢氧化铝和二氧化碳;
(4)根据反应量的关系,a点恰好消耗完H+,溶液中只有(NH4)2SO4与Na2SO4;c、d、b三点溶液均含有NH3•H2O,(NH4)2SO4可以促进水的电离,而NH3•H2O抑制水的电离,c点溶液呈中性,则溶液含有(NH4)2SO4、Na2SO4、NH3•H2O三种成分,据此回答.
解答 解:(1)①NH4Al(SO4)2中铝离子会抑制铵根离子的水解,②NH4HSO4中氢离子会抑制铵根离子的水解,且抑制程度大于铝离子,③NH4Cl中铵根离子的水解不受影响,④NH3•H2O属于弱碱,电离出的铵根离子浓度最小,⑤CH3COONH4中醋酸根离子会抑制铵根离子的水解,所以等浓度的以上化合物溶液中铵根浓度由大到小的顺序是②①③⑤④,故答案为:②①③⑤④;
(2)浓度相等的氨水和氯化铵混合,溶液显示碱性,氨水的电离程度大于铵根离子的水解程度;
A、如果溶液显酸性,则c(OHˉ)<c(H+),根据电荷守恒:c(C1ˉ)+c(OHˉ)=c(NH4+)+c(H+),存在c(C1ˉ)>c(NH4+),即c(C1ˉ)>c(NH4+)>c(H+)>c(OHˉ),故正确;
B、根据电荷守恒:c(C1ˉ)+c(OHˉ)=c(NH4+)+c(H+),如果c(C1ˉ)=c(NH4+),存在c(OHˉ)=c(H+),则溶液显中性,故正确;
C、根据电荷守恒:c(C1ˉ)+c(OHˉ)=c(NH4+)+c(H+),c(C1ˉ)>c(NH4+)>c(OHˉ)>c(H+)不会成立,故错误;
D、如果③和④等体积混合,则所得溶液满足物料守恒关系:c(NH4+)+c(NH3•H2O)=0.1mol•L-1,故错误;
E、所得溶液肯定满足电荷守恒关系:c(C1ˉ)+c(OHˉ)=c(NH4+)+c(H+),故正确;
故选ABE;
(3)Al3+水解生成的Al(OH)3发生反应为:Al3++3H2O?Al(OH)3(胶体)+3H+,Al(OH)3胶体吸附悬浮颗粒使其沉降从而净化水,向NH4Al(SO4)2溶液中加入小苏打溶液后,铝离子和碳酸氢根离子之间发生双水解反应可以得到氢氧化铝和二氧化碳,即Al3++3HCO3-=Al(OH)3↓+3CO2↑,
故答案为:Al3++3HCO3-=Al(OH)3↓+3CO2↑Al3+水解生成的Al(OH)3胶体具有吸附性,Al3++3H2O?Al(OH)3(胶体)+3H+,Al(OH)3胶体吸附悬浮颗粒使其沉降从而净化水;Al3++3HCO3-=Al(OH)3↓+3CO2↑;
(4)a、b、c、d四个点,根据反应量的关系,b点恰好消耗完H+,溶液中只有(NH4)2SO4与Na2SO4;c、d、b三点溶液均含有NH3•H2O,(NH4)2SO4可以促进水的电离,而NH3•H2O抑制水的电离,因此水的电离程度最大的是a点,溶液中c(OH-)的数值最接近NH3•H2O的电离常数K数值;c点溶液呈中性,即溶液含有(NH4)2SO4、Na2SO4、NH3•H2O三种成分,b点时c(Na+)=c(SO42-),b点时c(Na+)>c(SO42-),根据N元素与S元素的关系,可以得出c(SO42-)>c(NH4+),故c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+),
故答案为:a;c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+).
点评 本题考查了盐的水解原理、离子浓度大小的比较、等知识点,难度较大,(2)题是易错题,注意溶液混合后各种物质的浓度变为原来的一半,为易错点.

 名校课堂系列答案
名校课堂系列答案将上述物质序号按要求填入下表.
| 序号 | 符合的条件 | 物质的序号 |
| 1 | 电解质,但熔融状态下并不导电 | |
| 2 | 电解质,但难溶于水 | |
| 3 | 非电解质 | |
| 4 | 既不是电解质,也不是非电解质,但本身能导电 |
| A. | 通丙烷的电极为电池负极,发生的电极反应为:C3H8-20e-+10O2-═3CO2+4H2O | |
| B. | 该电池的总反应是:C3H8+5O2═3CO2+4H2O | |
| C. | 电路中每通过5mol电子,约有5.6L标准状况下的丙烷被完全氧化 | |
| D. | 在熔融电解质中,O2-由负极移向正极 |
①Na2CO3-制玻璃; ②SiO2-太阳能电池; ③Na2SiO3-木材防火剂; ④NH3-制冷剂;
⑤Al2O3-焊接钢轨; ⑥NaClO-消毒剂、漂白织物 ⑦Fe2O3-红色油漆或涂料.
| A. | 4个 | B. | 5个 | C. | 6个 | D. | 7个 |
| A. | c(Na+)=c(NH2-) | B. | c(NH4+)=1×10-29 mol•L-1 | ||
| C. | c(NH2-)>c(NH4+) | D. | c(NH4+).c(NH2-)=1.0×10-30 mol2•L-2 |
| A. | 烧碱溶液盛装在带有玻璃塞的试剂瓶中 | |
| B. | 少量金属钠保存在煤油中 | |
| C. | 向紫色石蕊试液中加入新制氯水,石蕊试液先变红后褪色 | |
| D. | 区别溶液和胶体的最简单的方法是丁达尔效应 |
| A. | Al2O3 | B. | CuO | C. | CaO | D. | Na2O2 |