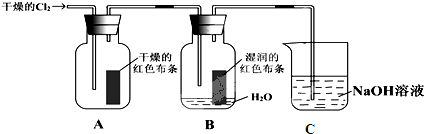
题目内容
13.现有200ml Fe2(SO4)3的溶液中含Fe3+5.6g,则溶液中SO42-的物质的量浓度是0.75mol•L-1.分析 根据n=$\frac{n}{V}$计算出5.6g铁离子的物质的量,再根据硫酸铁化学式计算出溶液中硫酸根离子的物质的量,再根据c=$\frac{n}{V}$计算出溶液中SO42-的物质的量浓度.
解答 解:5.6g铁离子的物质的量为:$\frac{5.6g}{56g/mol}$=0.1mol,根据化学式可知Fe2(SO4)3,200mL该溶液中含有硫酸根离子的物质的量为0.1mol×$\frac{3}{2}$=0.15mol,
则溶液中SO42-的物质的量浓度为:c(SO42-)=$\frac{0.15mol}{0.2L}$=0.75mol•L-1,
故答案为:0.75mol•L-1.
点评 本题考查了物质的量浓度的计算,题目难度中等,明确物质的量浓度的概念及表达式为解答关键,注意熟练掌握物质的量与摩尔质量、物质的量浓度之间的关系,试题培养了学生的化学计算能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.只改变一个影响因素,平衡常数K与化学平衡移动的关系叙述错误的是( )
| A. | 平衡移动,K值一定变化 | B. | K值变化,平衡一定移动 | ||
| C. | 平衡移动,K值可能不变 | D. | K值不变,平衡可能移动 |
1.已知M、Q、X、Y、Z是前四周期中元素(不包含稀有气体元素),有关性质和相关信息如下表:
(1)如图是不完整的元素周期表,补全元素周期表的轮廓,并将Y的元素符号填在元素周期表中相应的位置上.
(2)M与Z形成的含有共价键的化合物的电子式为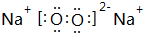
(3)M、Q、Z简单离子的半径由大到小的顺序为Cl->O2->Na+(用离子符号表示)
(4)用一个化学方程式表示证明非金属性Q>X:H2S+Cl2=2HCl+S↓
(5)5.6L标准状况下的X的简单氢化物在足量的Z单质中完全燃烧生成液态水时,放出的热量为356.8kJ.该反应的热化学方程式为2H2S(g)+3O2(g)=2SO2(g)+2H2O(l)△H=-2854.4kJ/mol
(6)在碱性条件下,Q的单质可与YZ2-反应制备一种可用于净水的盐YZ42-,该反应的离子方程式为3Cl2+2FeO2-+8OH-=2FeO42-+6Cl-+4H2O.
| 元素 | 相关信息 |
| M | 最高价氧化物对应的水化物能按1:1电离出电子数相等的阴、阳离子 |
| Q | 所在主族序数与所在周期序数之差为4,非金属性在同周期元素中最强 |
| X | 其单质为淡黄色晶体 |
| Y | 某种核素原子的质量数为56,中子数为30 |
| Z | X元素的单质在Z元素的单质中燃烧,发出明亮的蓝紫色火焰 |

(3)M、Q、Z简单离子的半径由大到小的顺序为Cl->O2->Na+(用离子符号表示)
(4)用一个化学方程式表示证明非金属性Q>X:H2S+Cl2=2HCl+S↓
(5)5.6L标准状况下的X的简单氢化物在足量的Z单质中完全燃烧生成液态水时,放出的热量为356.8kJ.该反应的热化学方程式为2H2S(g)+3O2(g)=2SO2(g)+2H2O(l)△H=-2854.4kJ/mol
(6)在碱性条件下,Q的单质可与YZ2-反应制备一种可用于净水的盐YZ42-,该反应的离子方程式为3Cl2+2FeO2-+8OH-=2FeO42-+6Cl-+4H2O.
3.下列物质所属的类别正确的是( )
| A. | 纯碱--盐 | B. | 干冰--混合物 | ||
| C. | 澄清石灰水--纯净物 | D. | 洁净的空气--纯净物 |
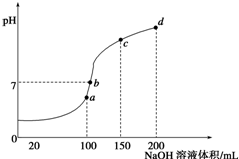 有下列化合物:①NH4Al(SO4)2、②NH4HSO4、③NH4Cl、④NH3•H2O、⑤CH3COONH4,回答下列问题.
有下列化合物:①NH4Al(SO4)2、②NH4HSO4、③NH4Cl、④NH3•H2O、⑤CH3COONH4,回答下列问题.