题目内容
4.在1~18号元素中,稀有气体元素除外(请用元素符号或化学式表示):(1)原子半径最大的元素是Na;
(2)最外层电子数是内层电子数的一半的元素Li、Si;
(3)单质还原性最强的元素是Na;
(4)最高价氧化物对应的水化物最强的酸是HClO4;
(5)最高正价与负价的绝对值之差为6的元素是Cl;
(6)常温下既能溶于强酸,又能溶于强碱的氧化物是Al2O3.
分析 (1)同周期随原子序数增大,原子半径减小,电子层越多,原子半径越大;
(2)最外层电子数是内层电子数的一半的元素,若为两个电子层为Li;若为三个电子层为Si;
(3)同周期自左而右金属性减弱、非金属性增强,同主族自上而下金属性减弱、非金属性增强;
(4)非金属性越强,最高价氧化物对应的水化物越强,但O、F无正价;
(5)最高正价与负价的绝对值之差为6的元素,位于第ⅤⅡA族;
(6)氧化铝具有两性.
解答 解:(1)同周期随原子序数增大,原子半径减小,电子层越多,原子半径越大,则短周期中Na的原子半径最大,故答案为:Na;
(2)最外层电子数是内层电子数的一半的元素,若为两个电子层为Li;若为三个电子层为Si,故答案为:Li、Si;
(3)同周期自左而右金属性减弱、非金属性增强,同主族自上而下金属性减弱、非金属性增强,则短周期中Na的还原性最强,故答案为:Na;
(4)非金属性越强,最高价氧化物对应的水化物越强,但O、F无正价,则Cl的最高价氧化物对应的水化物HClO4的酸性最强,故答案为:HClO4;
(5)最高正价与负价的绝对值之差为6的元素,位于第ⅤⅡA族,F没有正价,则符合的为Cl,故答案为:Cl;
(6)Al2O3具有两性,常温下既能溶于强酸,又能溶于强碱,故答案为:Al2O3.
点评 本题考查元素周期表的结构与应用,为高频考点,把握元素的位置、性质及应用为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
14.AlCl3易溶于四氯化碳,加热到180℃升华.推测三氯化铝有可能属于( )
| A. | 原子晶体 | B. | 分子晶体 | C. | 离子晶体 | D. | 金属晶体 |
15.合金的用途广泛.下列物质不属于合金的是( )
| A. | 水银 | B. | 青铜 | C. | 硬铝 | D. | 不锈钢 |
12.从结构上分析推测,CH2=CHCOOCH2CH3,最不可能具有的性质是( )
| A. | 能使溴水褪色 | B. | 能使酸性高锰酸钾溶液褪色 | ||
| C. | 能水解 | D. | 能够与Na2CO3溶液反应 |
19.下列属于极性分子的是( )
| A. | NH3 | B. | H2 | C. | CH4 | D. | BF3 |
9.烷基取代苯 可被酸性高锰酸钾溶液氧化为
可被酸性高锰酸钾溶液氧化为 (苯甲酸),但若烷基R中直接与苯环相连接的碳原子上没有C-H键,则不容易被氧化得到苯甲酸.据此判断,分子式为C11H16的一烷基取代苯,可以被氧化为苯甲酸的异构体共有( )
(苯甲酸),但若烷基R中直接与苯环相连接的碳原子上没有C-H键,则不容易被氧化得到苯甲酸.据此判断,分子式为C11H16的一烷基取代苯,可以被氧化为苯甲酸的异构体共有( )
 可被酸性高锰酸钾溶液氧化为
可被酸性高锰酸钾溶液氧化为 (苯甲酸),但若烷基R中直接与苯环相连接的碳原子上没有C-H键,则不容易被氧化得到苯甲酸.据此判断,分子式为C11H16的一烷基取代苯,可以被氧化为苯甲酸的异构体共有( )
(苯甲酸),但若烷基R中直接与苯环相连接的碳原子上没有C-H键,则不容易被氧化得到苯甲酸.据此判断,分子式为C11H16的一烷基取代苯,可以被氧化为苯甲酸的异构体共有( )| A. | 6种 | B. | 7种 | C. | 8种 | D. | 9种 |
14.下列有关水溶液中离子平衡关系的说法中,正确的是( )
| A. | 在0.1 mol•L-1FeCl3溶液中,Na+、NH4+、HCO3-、ClO-一定大量共存 | |
| B. | 常温下,某溶液中由水电离出的c(H+)=1×10-amol•L-1,则该溶液一定pH=a | |
| C. | 相同物质的量浓度下列溶液:①NH4Al(SO4)2;②NH4Cl;③CH3COONH4;④NH3•H2O.其中c(NH4+)由大到小的顺序是①>②>③>④ | |
| D. | AgCl悬浊液中存在如下平衡:AgCl(s)?Ag+(aq)+Cl-(aq).向其中加入少量NaCl晶体,平衡逆向移动,故AgCl溶解度减少,溶度积Ksp也减少 |
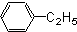 芳香烃,(7)
芳香烃,(7)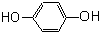 酚,(8)
酚,(8)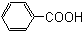 芳香酸.
芳香酸.
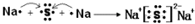 ,其所含化学键类型为离子键.
,其所含化学键类型为离子键.