��Ŀ����
����Ŀ����������M�� ����һ�ֿ���ʪ�Թؽ���ҩ���ϳ�·����ͼ��
����һ�ֿ���ʪ�Թؽ���ҩ���ϳ�·����ͼ��
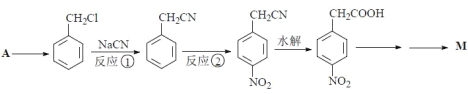
���������գ�
��1����Ӧ�ٵķ�Ӧ����Ϊ_____��
��2����Ӧ�����õ��Լ�Ϊ_____��
��3��![]() ������ͬϵ�����ͨ��������Ӧ�Ƶñ���ȩ����д���ڶ�����Ӧ�Ļ�ѧ����ʽ_____������ȩ��ͬ���ͬ���칹����_____�֡�
������ͬϵ�����ͨ��������Ӧ�Ƶñ���ȩ����д���ڶ�����Ӧ�Ļ�ѧ����ʽ_____������ȩ��ͬ���ͬ���칹����_____�֡�
��4��д���ɶ����������ᣨ![]() ���õ������������������Ļ�ѧ����ʽ_____��
���õ������������������Ļ�ѧ����ʽ_____��
��5��A�ķ���ʽΪC7H8��д����A�ϳ�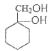 �ĺϳ�·��_____��
�ĺϳ�·��_____��
���ϳ�·�߳��õı�ʾ��ʽΪ��A![]() B����
B����![]() Ŀ����
Ŀ����
���𰸡�ȡ����Ӧ Ũ���ᡢŨ���� 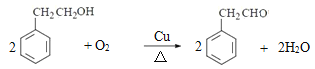 3
3 ![]()
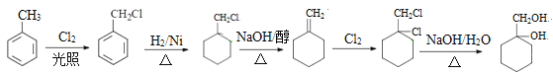
��������
��A![]()
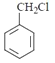 ���A�ķ���ʽΪC7H8����AΪ
���A�ķ���ʽΪC7H8����AΪ![]() ����������ȡ����Ӧ����Ӧ��������Cl2��ϲ����գ���
����������ȡ����Ӧ����Ӧ��������Cl2��ϲ����գ���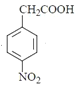
![]() M����֪
M����֪ �ȷ�����ԭ��Ӧ����
�ȷ�����ԭ��Ӧ����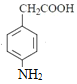 ������CH3COOH����ȡ����Ӧ�����ļ��õ�
������CH3COOH����ȡ����Ӧ�����ļ��õ�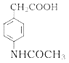 ���ݴ˷������⡣
���ݴ˷������⡣
(1)��Ӧ��Ϊ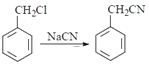 ����Ӧ����Ϊȡ����Ӧ��
����Ӧ����Ϊȡ����Ӧ��
(2)��Ӧ��Ϊ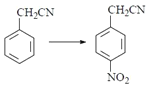 ���DZ���������-NO2������ȡ����Ӧ�����õ��Լ�ΪŨ���ᡢŨ���
���DZ���������-NO2������ȡ����Ӧ�����õ��Լ�ΪŨ���ᡢŨ���
(3)![]() ������ͬϵ�����ͨ��������Ӧ�Ƶñ���ȩ������л���Ϊ
������ͬϵ�����ͨ��������Ӧ�Ƶñ���ȩ������л���Ϊ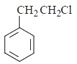 ����ˮ������
����ˮ������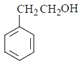 ���ٴ��������ɱ���ȩ�����д�����ʱ������Ӧ�Ļ�ѧ����ʽΪ
���ٴ��������ɱ���ȩ�����д�����ʱ������Ӧ�Ļ�ѧ����ʽΪ ������ȩ��ͬ��ͬ���칹����ָ�����Ϻ���1������1��ȩ������ȡ�������ڡ��䡢��λ�������������3�ַ���������ͬ���칹�壻
������ȩ��ͬ��ͬ���칹����ָ�����Ϻ���1������1��ȩ������ȡ�������ڡ��䡢��λ�������������3�ַ���������ͬ���칹�壻
(4)������������(![]() )���Ҵ�����������Ӧ�õ�������������������������Ӧ�Ļ�ѧ����ʽΪ
)���Ҵ�����������Ӧ�õ�������������������������Ӧ�Ļ�ѧ����ʽΪ![]() ��
��
(5)��A�ϳ�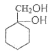 ����A�ķ���ʽΪC7H8�����Ŀ����ﺬ����Ԫ���ṹ����AΪ
����A�ķ���ʽΪC7H8�����Ŀ����ﺬ����Ԫ���ṹ����AΪ![]() ��
�� �к���2�����ǻ���������
�к���2�����ǻ���������![]() ��NaOH��Һ��ˮ��õ���ͬ��
��NaOH��Һ��ˮ��õ���ͬ��![]() ������
������![]() �����ӳɷ�Ӧ�õ����ٽ��
�����ӳɷ�Ӧ�õ����ٽ��![]() ��Cl2�ڹ�����������ȡ����Ӧ����
��Cl2�ڹ�����������ȡ����Ӧ���� �������ϳ�����Ϊ
�������ϳ�����Ϊ ��
��

 �¿α�����Ķ�ѵ��ϵ�д�
�¿α�����Ķ�ѵ��ϵ�д�����Ŀ��CO��H2��ú�����������������������;�㷺��
��1��CO��ԭ������������Ⱦ��SO2
��2CO��g�� + SO2��g�� ![]() S��s��+2CO2��g�� H = -270 kJ��mol��1���÷�Ӧ��ƽ�ⳣ������ʽΪ__��
S��s��+2CO2��g�� H = -270 kJ��mol��1���÷�Ӧ��ƽ�ⳣ������ʽΪ__��
���ھ��Ⱥ��ݵ��ܱ������н���������Ӧ������˵����ȷ����_____��
a ����������ܶȱ��ֲ��䣬���Ѵ�ƽ��״̬
b ��ƽ������ٳ���һ����CO2��ƽ�ⳣ�����ֲ���
c ���������S�������淴Ӧ���ʾ����ֲ��䣬ƽ�ⲻ�ƶ�
d �ӷ�Ӧ��ʼ��ƽ�⣬�����������ѹǿ���ֲ���
����2 L���º����ܱ�������ͨ��2 mol CO��1 mol SO2���ֱ����a��b��c����ʵ�顣�ڲ�ͬ�������·�����Ӧ��2CO��g�� + SO2��g�� ![]() S��s��+2CO2��g�� H = -270 kJ��mol��1����Ӧ��ϵ��ѹ��ʱ��ı仯���±���ʾ��������ʵ���¶ȵĴ�С��ϵ��_____����a��b��c��ʾ����ʵ��a�ӷ�Ӧ��ʼ��45s�ﵽƽ�⣬��ù��̷�Ӧ����v��SO2��__________���������2λ��Ч���֣���
S��s��+2CO2��g�� H = -270 kJ��mol��1����Ӧ��ϵ��ѹ��ʱ��ı仯���±���ʾ��������ʵ���¶ȵĴ�С��ϵ��_____����a��b��c��ʾ����ʵ��a�ӷ�Ӧ��ʼ��45s�ﵽƽ�⣬��ù��̷�Ӧ����v��SO2��__________���������2λ��Ч���֣���
| 0s | 40s | 45s | 60s |
a | 175 | 142 | 140 | 140 |
b | 160 | 120 | 120 | 120 |
c | 160 | 130 | 125 | 120 |
��2������CO��H2���Ʊ���Ȼ������Ҫ��ӦΪ��
CO��g�� + 3H2��g�� ![]() CH4��g�� + H2O��g�� H1=-206.2 kJ��mol��1��
CH4��g�� + H2O��g�� H1=-206.2 kJ��mol��1��
CO��g�� + H2O��g�� ![]() CO2��g�� + H2��g�� H2 = -41.0 kJ��mol��1��
CO2��g�� + H2��g�� H2 = -41.0 kJ��mol��1��
H2O��l�� �TH2O��g�� H3 =+44 kJ��mol��1 ��
�ش��������⣺
�ٷ�ӦCO2��g�� + 4H2��g�� ![]() CH4��g�� + 2H2O��l�� ��H4 = ________ kJ��mol��1��ij�¶��£��ֱ�����ʼ�ݻ���ͬ�ĺ�ѹ����A����������B�м���1molCO2��4molH2�Ļ�����壬��������Ӧ�ﵽƽ���ų������յ������϶����__�� ����A������B"����
CH4��g�� + 2H2O��l�� ��H4 = ________ kJ��mol��1��ij�¶��£��ֱ�����ʼ�ݻ���ͬ�ĺ�ѹ����A����������B�м���1molCO2��4molH2�Ļ�����壬��������Ӧ�ﵽƽ���ų������յ������϶����__�� ����A������B"����
���ں�ѹ�ܵ���Ӧ���а�n��H2��:n��CO�� = 3:1ͨ��ԭ�������ڴ����������Ʊ��ϳ���Ȼ����400 �� p��Ϊ100 kPaʱ��Ӧ��ϵƽ��������±���ʾ��
��� | CH4 | H2O | H2 | CO2 | CO |
�������/% | 45.0 | 42.5 | 10.0 | 1.50 | 1.00 |
���������CO����ת������=____��![]()
���Ʊ��ϳ���Ȼ��������ԭ������ͨ��ˮ���������������̼��
��̼��ӦΪ����ӦI ��CH4��g�� ![]() C��s�� + 2H2��g�� H = +75 kJ��mol��1��
C��s�� + 2H2��g�� H = +75 kJ��mol��1��
��Ӧ��2CO��g�� ![]() C��s�� + CO2��g�� H = -172 kJ��mol��1��
C��s�� + CO2��g�� H = -172 kJ��mol��1��
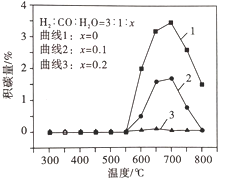
ƽ����ϵ��ˮ����Ũ�ȶԻ�̼����Ӱ����ͼ��ʾ������˵����ȷ����__��
A ����1��700 ~ 800���̼����С��ԭ������Ƿ�Ӧ�������ƶ�
B ����1��550 ~700���̼�������ԭ������Ƿ�ӦI�������������
C ����2��3��550 ~800���̼���ϵ͵�ԭ����ˮ����ϡ������ʹ��̼��Ӧ���ʼ�С
D ˮ���������շ�Ӧ�ų���������������ϵ�¶���550�����£������ڼ��ٻ�̼
����Ŀ����ʵ�����У�������̼�����ơ��Ȼ��ơ��Ȼ�淋������ܽ�ȵIJ��죬ͨ������ʳ��ˮ�����Ͷ�����̼��Ӧ�����̼�����ƾ��壬��Ӧԭ���������»�ѧ����ʽ��ʾ��NH3+CO2+NaCl+H2O=NH4Cl+NaHCO3�������ݴ�ԭ�������Ƶ�̼�����ƾ��壬ijУѧ���������ʵ��װ�ã�����Bװ���е��Թ��������а����Ȼ��Ƶ���Һ���Ҷ��߾��Ѵﵽ���ͣ�
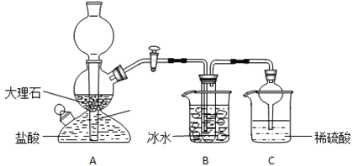
(1)Aװ������������Ӧ�����ӷ���ʽΪ��_________________��Cװ����ϡ���������Ϊ��________________��
(2)�±������г�������������ڲ�ͬ�¶��µ��ܽ�����ݣ�g/100gˮ��
0�� | 10�� | 20�� | 30�� | 40�� | 50�� | |
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 |
NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
���ձ������ݣ������Bװ����ʹ�ñ�ˮ����Ϊ________________��
(3)��Уѧ���ڼ�������װ�������Ժ����ʵ�飬���û�еõ�̼�����ƾ��壬ָ����ʦָ��Ӧ�� ______װ��____֮�䣨��д��ĸ������һ��ʢ��_________ ��ϴ��װ�ã���������___________
(4)���øĽ����װ�ý���ʵ�飬��B�е��Թ��������˾��壬����Ҫ�IJ�����õ���һ�ִ����ľ��塣��ͨ����ʵ���жϸþ�����̼�����ƾ��������̼����茶��壬��������������ʵ�������ۣ�______________��
(5)����Уѧ������ʵ��ʱ�����ñ���ʳ��ˮ�к�NaCl������Ϊ5.85g��ʵ���õ������NaHCO3���������Ϊ5.88g����NaHCO3�IJ���Ϊ__________��