题目内容
设NA为阿伏加德罗常数的值,下列说法全部错误的组合是( )
a 12g金刚石中含有的碳碳键的数目为2NA
b 1mol明矾与水完全反应转化为氢氧化铝胶体后,其中胶体粒子的数目为NA
c 标准状况下,2.24L乙烯和丙烯等物质的量混合气体中含有的共用电子对的数目为0.75NA
d 常温下,1mol?L-1的NH4NO3溶液中含有氮原子的数目为2NA
e 标准状况下,2.24L C6H14含原子总数大于2NA
f 17g H2O2中含有的电子数为9NA
g 将2mol SO2与1mol O2混合,发生反应转移的电子总数一定是4NA
h 常温下100mL 1mol?L-1 AlCl3溶液中阳离子总数大于0.1NA.
a 12g金刚石中含有的碳碳键的数目为2NA
b 1mol明矾与水完全反应转化为氢氧化铝胶体后,其中胶体粒子的数目为NA
c 标准状况下,2.24L乙烯和丙烯等物质的量混合气体中含有的共用电子对的数目为0.75NA
d 常温下,1mol?L-1的NH4NO3溶液中含有氮原子的数目为2NA
e 标准状况下,2.24L C6H14含原子总数大于2NA
f 17g H2O2中含有的电子数为9NA
g 将2mol SO2与1mol O2混合,发生反应转移的电子总数一定是4NA
h 常温下100mL 1mol?L-1 AlCl3溶液中阳离子总数大于0.1NA.
| A、a c f h |
| B、a c e g |
| C、a c e f h |
| D、b d g |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:a 金刚石中,每个C与其它4个C形成4个碳碳键;
b 氢氧化铝胶体为氢氧化铝的聚集体,无法计算胶粒的数目;
c 乙烯和丙烯中,每个碳原子平均形成1对共用电子对,每个氢原子形成1对共用电子对;
d 缺少硝酸铵溶液的体积,无法计算溶液中氮原子的数目;
e 标准状况下,己烷为液体,己烷的摩尔体积小于22.4L/mol;
f 双氧水中含有18个电子,17g双氧水的物质的量为0.5mol,含有9mol电子;
g 二氧化硫与氧气的反应为可逆反应,反应物不可能完全转化成生成物;
h 铝离子部分水解,导致溶液中阳离子数目增多.
b 氢氧化铝胶体为氢氧化铝的聚集体,无法计算胶粒的数目;
c 乙烯和丙烯中,每个碳原子平均形成1对共用电子对,每个氢原子形成1对共用电子对;
d 缺少硝酸铵溶液的体积,无法计算溶液中氮原子的数目;
e 标准状况下,己烷为液体,己烷的摩尔体积小于22.4L/mol;
f 双氧水中含有18个电子,17g双氧水的物质的量为0.5mol,含有9mol电子;
g 二氧化硫与氧气的反应为可逆反应,反应物不可能完全转化成生成物;
h 铝离子部分水解,导致溶液中阳离子数目增多.
解答:
解:a 12g 金刚石中含有1molC,每个C原子与其它4个C形成了4个共价键,根据均摊法,每个C形成的共价键数为:
×4=2,所以1molC形成了2mol碳碳键,含有的碳碳键的数目为2NA,故a正确;
b 1mol 明矾与水完全反应转化为氢氧化铝胶体后,由于氢氧化铝胶粒为氢氧化铝的聚集体,所以生成的胶粒数目小于1mol,其中胶体粒子的数目小于NA,故b错误;
c 标准状况下,2.24L乙烯和丙烯的总物质的量为0.1mol,各含有0.05mol乙烯和0.05mol丙烯;0.05mol乙烯中含有0.1mol碳碳共用电子对和0.2mol碳氢共用电子对;0.05mol丙烯中含有0.15mol碳碳共用电子对和0.3mol碳氢共用电子对,所以0.1mol质的量混合气体中总共含有0.75mol共用电子对,含有的共用电子对的数目为0.75NA,故c正确;
d 没有告诉1mol?L-1的NH4NO3溶液的体积,无法计算溶液中氮原子数目,故d错误,
e 标准状况下,己烷的摩尔体积小于22.4L/mol,2.24L己烷的物质的量大于0.1mol,含原子的物质的量大于2mol,原子总数大于2NA,故e正确;
f 17g 双氧水的物质的量为0.5mol,0.5mol双氧水中含有9mol电子,0.5molH2O2中含有的电子数为9NA,故f正确;
g 将2molSO2与1molO2混合,由于该反应为可逆反应,反应生成的三氧化硫的物质的量小于2mol,反应转移的电子小于4mol,转移的电子总数一定小于4NA,故g错误;
h 常温下,100mL 1mol?L-1 AlCl3溶液中含有溶质氯化铝0.1mol,由于铝离子部分水解,溶液中阳离子数目增多,阳离子物质的量大于0.1mol,阳离子总数大于0.1NA,故h正确;
根据以上分析可知,错误的有:bdg,
故选D.
| 1 |
| 2 |
b 1mol 明矾与水完全反应转化为氢氧化铝胶体后,由于氢氧化铝胶粒为氢氧化铝的聚集体,所以生成的胶粒数目小于1mol,其中胶体粒子的数目小于NA,故b错误;
c 标准状况下,2.24L乙烯和丙烯的总物质的量为0.1mol,各含有0.05mol乙烯和0.05mol丙烯;0.05mol乙烯中含有0.1mol碳碳共用电子对和0.2mol碳氢共用电子对;0.05mol丙烯中含有0.15mol碳碳共用电子对和0.3mol碳氢共用电子对,所以0.1mol质的量混合气体中总共含有0.75mol共用电子对,含有的共用电子对的数目为0.75NA,故c正确;
d 没有告诉1mol?L-1的NH4NO3溶液的体积,无法计算溶液中氮原子数目,故d错误,
e 标准状况下,己烷的摩尔体积小于22.4L/mol,2.24L己烷的物质的量大于0.1mol,含原子的物质的量大于2mol,原子总数大于2NA,故e正确;
f 17g 双氧水的物质的量为0.5mol,0.5mol双氧水中含有9mol电子,0.5molH2O2中含有的电子数为9NA,故f正确;
g 将2molSO2与1molO2混合,由于该反应为可逆反应,反应生成的三氧化硫的物质的量小于2mol,反应转移的电子小于4mol,转移的电子总数一定小于4NA,故g错误;
h 常温下,100mL 1mol?L-1 AlCl3溶液中含有溶质氯化铝0.1mol,由于铝离子部分水解,溶液中阳离子数目增多,阳离子物质的量大于0.1mol,阳离子总数大于0.1NA,故h正确;
根据以上分析可知,错误的有:bdg,
故选D.
点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,试题题量较大,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系.

练习册系列答案
相关题目
化学与生活是紧密相联的,下列说法正确的是( )
| A、为防止中秋月饼等富脂食品氧化变质,常在包装袋中放入生石灰 |
| B、发酵粉能使烘焙出的糕点疏松多孔,是因为发酵粉中含有碳酸钠 |
| C、针对甲型H1N1流感的扩散情况,要加强环境、个人等的消毒预防,其中消毒剂常选用含氯消毒剂、双氧水、酒精等适宜的物质 |
| D、加碘食盐中添加碘酸钾而不是碘化钾,是因为碘酸钾能溶于水而碘化钾不溶于水 |
(NH4)2SO4在一定条件下发生如下分解反应:4(NH4)2SO4
N2↑+6NH3↑+3SO2↑+SO3↑+7H2O将反应后的混合气体通入一定量的氯化钡溶液中,下列说法中不正确的是( )
| 高温 |
| A、一定没有亚硫酸钡沉淀 |
| B、一定有硫酸钡沉淀生成 |
| C、得到的沉淀是亚硫酸钡和硫酸钡的混合物 |
| D、逸出的气体是氨气和二氧化硫气体 |
下列各组物质在溶液中反应时,以任意比例混合均能用同一离子方程式表示的是( )
| A、AgNO3溶液和稀氨水 |
| B、Na2S和盐酸 |
| C、AlCl3溶液和氨水 |
| D、Fe和稀硝酸 |
下列反应中,属于加成反应的是( )
| A、乙烯通入酸性KMnO4溶液 |
| B、乙烷与溴蒸气反应 |
| C、乙烯在一定条件下与水反应生成乙醇 |
| D、乙烯燃烧生成二氧化碳和水 |
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示,下列分析或结果错误的是( )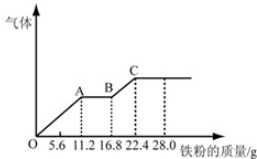

| A、原混合酸中NO3-的物质的量为0.4mol |
| B、OA段产生的是NO,AB段的反应为Fe+2Fe3+═3Fe2+,BC段产生氢气 |
| C、第二份溶液中最终溶质为FeSO4 |
| D、H2SO4浓度为4mol?L-1 |
在下列给定条件的溶液中,一定能大量共存的粒子组是( )
| A、能使pH试纸呈红色的溶液:Na+、NH4+、I-、NO3- | ||
B、常温下,
| ||
| C、水电离的c(H+)水=1.0×10-13mol?L-1溶液中:AlO2-、K+、SO42-、Br- | ||
| D、与铝反应产生大量氢气的溶液:Na+、K+、NH4+、NO3- |
某体积可变的密闭容器,盛有体积比为2:3的N2和H2,在一定条件下发生反应N2(g)+3H2(g)?2NH3(g),若维持温度和压强不变,当达到平衡时,容器的体积为V,其中NH3的体积占20%,下列说法正确的是( )
| A、原混合气体的体积为1.2V |
| B、原混合气体的体积为1.1V |
| C、反应中消耗N2的体积为0.3V |
| D、达到平衡时,消耗H2体积为0.1V |