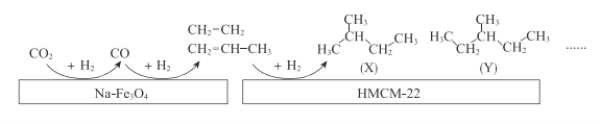
题目内容
【题目】A元素原子L层电子数是K层电子数的2倍,B元素原子次外层电子数是最外层电子数的2倍,关于A、B元素的说法,下列正确的是
A.A元素一定是第2周期元素
B.A、B元素一定是同一周期元素
C.A、B元素可能属于同一主族
D.A、B元素一定分别位于第2、3周期
【答案】AC
【解析】
A元素原子L层电子数是K层电子数的2倍,则A为C;B元素原子次外层电子数是最外层电子数的2倍,则B为Li或Si。
A. A元素为C,为第二周期元素,故A正确;
B. 若B为Si,则二者不是同一周期,故B错误;
C. 若B为Si,则二者为同一主族,故C正确;
D. 若B为Li,则二者同属第二周期,故D错误;
故答案为AC。

 阅读快车系列答案
阅读快车系列答案【题目】探究0.5mol/L FeCl3溶液(pH=1)与不同金属反应时的多样性的原因。 (各组实验中:所用FeCl3溶液体积相同;金属过量;静置、不振荡)
实验 | 金属 | 现象及产物检验 |
I | 镁条 | 立即产生大量气体;金属表面变黑,该黑色固体能被磁铁吸引;液体颜 色由棕黄色逐渐变为红褐色;片刻后气泡减少;金属表面覆盖有红褐色沉淀,此时取反应后的液体, 滴加K3[Fe(CN)6]溶液,生成蓝色沉淀。 |
II | 铜粉 | 无气体产生;溶液逐渐变为蓝绿色;取反应后的溶液,滴加K3[Fe(CN)6]溶液,生成蓝色沉淀。 |
(1)根据实验I的现象,推测红褐色液体为胶体,并用光束照射该液体,在与光束垂直的方向观察到_________得以证实。
(2)已知Fe和Fe3O4均能被磁铁吸引。
①为了确定黑色固体的成分是否含有Fe和Fe3O4,重复实验I,及时取少量镁条表面生成的黑色粉末,洗净后进行实验如下:
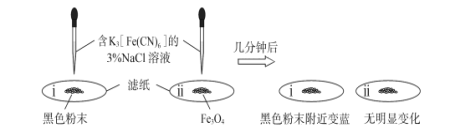
该实验说明黑色固体中一定含有_________,结合现象写出判断的理由_________。
②除上述结论外,分析实验I的现象,可知被还原得到的产物一定还有_________。
(3)实验Ⅰ、Ⅱ现象的差异,与Fe3+、Mg2+、Fe2+、H+、Cu2+的氧化性强弱有关,其顺序是Mg2+<Fe2+<_________。
(4)继续研究0.5mol/L FeCl3溶液(pH=1)与Fe的反应。
实验 | 金属 | 现象及产物检验 |
Ⅲ | 铁粉 | 持续产生少量气体;一段时间后,溶液颜色变浅,底部有红褐色沉 淀,经检验,溶液pH=4;含有Fe2+,无Fe3+。 |
Ⅳ | 铁丝 | 无明显的气泡产生;一段时间后,溶液变为浅绿色,经检验,溶液 pH=2,含有Fe2+和Fe3+;Fe3+被还原的量多于实验Ⅲ。 |
①实验Ⅲ中发生反应的离子方程式有_________。
②已知:相同条件下,H+在溶液中的移动速率远大于Fe3+。 结合实验I、Ⅱ,由反应中金属表面离子浓度的变化,推测实验III、IV现象差异的原因:_________。