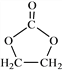
题目内容
【题目】CO2的有效利用可以缓解温室效应和能源短缺问题。
(1)CO2的分子结构决定了其性质和用途。
①CO2的电子式是_____,所含化学键类型为______共价键(填“非极性”或“极性”)。
②在温度高于31.26 ℃、压强高于7.29×106Pa时,CO2处于超临界状态,称为超临界CO2流体,它可用作萃取剂提取草药中的有效成分。与用有机溶剂萃取相比,用超临界CO2萃取的优点有:_____(答出一点即可)。
(2)中科院大连化学物理研究所的科研人员在新型纳米催化剂Na-Fe3O4和HMCM-22 的表面将CO2转化为烷烃,其过程如下图。

上图中CO2转化为CO的反应为:CO2(g)+H2(g)=CO(g)+H2O(g) △H=+41kJ/mol
已知:2CO2(g)+6H2(g)=C2H4(g)+4H2O(g) △H=-128kJ/mol
①则图中CO转化为C2H4的热化学方程式是__________。
②按系统命名法,图中X的名称是__________。
③关于X与Y的说法正确的是__________(填序号〕。
a.实验式相同 b.都有4种一氯代物 c.都易使酸性KMnO4溶液褪色
④催化剂中Fe3O4的制备方法如下:将一定比例的FeCl2和FeCl3溶于盐酸,然后在 60 ℃下逐滴加入NaOH溶液至pH≈10,继续搅拌,得Fe3O4。该反应的离子方程式是_________。
【答案】![]() 极性 萃取剂与溶质更易分离或萃取剂更环保等 2CO(g) + 4H2(g) = C2H4(g) + 2H2O(g) ΔH =﹣210 kJ/mol 2-甲基丁烷 b Fe2+ + 2Fe3+ + 8OH﹣ = Fe3O4↓+ 4H2O
极性 萃取剂与溶质更易分离或萃取剂更环保等 2CO(g) + 4H2(g) = C2H4(g) + 2H2O(g) ΔH =﹣210 kJ/mol 2-甲基丁烷 b Fe2+ + 2Fe3+ + 8OH﹣ = Fe3O4↓+ 4H2O
【解析】
(1)①CO2中每个碳原子形成4个共用电子对,其电子式为![]() ,其中碳和氧形成的共价键均是极性共价键,电子对偏向氧原子;②与用有机溶剂萃取相比,用超临界CO2流体萃取,可以更好地实现萃取剂与溶质的分离,萃取剂更加的环保,对环境的污染少等;(2)①将所给的CO2(g)+H2(g)=CO(g)+H2O(g) △H=+41kJ/mol,将式子反向并乘以2,与所给的2CO2(g)+6H2(g)=C2H4(g)+4H2O(g) △H=-128kJ/mol 相加可得:2CO(g)+4H2(g) = C2H4(g)+2H2O(g) ΔH =﹣210 kJ/mol;②图中最长碳链为4个碳,从左侧开始编号,所以该烷烃的名称为2-甲基丁烷;③X与Y是两种烷烃,实验式分别为C5H12和C3H7,明显不同,a项错误;考查对称性不难发现,它们的一氯代物都只有4种,b项正确;作为烷烃,均不能使酸性KMnO4溶液褪色,c项错误;答案选b。④题目已告知反应的微粒有Fe2+、Fe3+和NaOH,生成物有Fe3O4,暂定Fe3O4系数为1,根据电荷守恒和原子守恒即可顺利写出离子方程式为:Fe2++2Fe3++8OH-= Fe3O4↓+4H2O。
,其中碳和氧形成的共价键均是极性共价键,电子对偏向氧原子;②与用有机溶剂萃取相比,用超临界CO2流体萃取,可以更好地实现萃取剂与溶质的分离,萃取剂更加的环保,对环境的污染少等;(2)①将所给的CO2(g)+H2(g)=CO(g)+H2O(g) △H=+41kJ/mol,将式子反向并乘以2,与所给的2CO2(g)+6H2(g)=C2H4(g)+4H2O(g) △H=-128kJ/mol 相加可得:2CO(g)+4H2(g) = C2H4(g)+2H2O(g) ΔH =﹣210 kJ/mol;②图中最长碳链为4个碳,从左侧开始编号,所以该烷烃的名称为2-甲基丁烷;③X与Y是两种烷烃,实验式分别为C5H12和C3H7,明显不同,a项错误;考查对称性不难发现,它们的一氯代物都只有4种,b项正确;作为烷烃,均不能使酸性KMnO4溶液褪色,c项错误;答案选b。④题目已告知反应的微粒有Fe2+、Fe3+和NaOH,生成物有Fe3O4,暂定Fe3O4系数为1,根据电荷守恒和原子守恒即可顺利写出离子方程式为:Fe2++2Fe3++8OH-= Fe3O4↓+4H2O。