题目内容
10.铁酸锌(ZnFe2O4)是对可见光敏感的半导体催化剂,其实验室制备原理为:Zn2++2Fe2++3C2O42-+6H2O$\frac{\underline{\;75℃\;}}{\;}$ ZnFe2(C2O4)3•6H2O↓ …(a)
ZnFe2(C2O4)3•6H2O $\frac{\underline{\;高温\;}}{\;}$ ZnFe2O4+2CO2↑+4CO↑+6H2O …(b)
已知:ZnC2O4和FeC2O4难溶于水.
(1)上述制备原理中不属于氧化还原反应的是a(选填:“a”或“b”).
(2)制备ZnFe2(C2O4)3•6H2O时,可选用的药品有:
Ⅰ.(NH4)2Fe(SO4)2•6H2OⅡ.ZnSO4•7H2OⅢ.(NH4)2C2O4•7H2O.
①称量药品时,必须严格控制n(Fe2+)/n (Zn2+)=2:1.
②选用的加料方式是c(填字母).
a.按一定计量比,Ⅰ、Ⅱ、Ⅲ同时加入反应器并加水搅拌,然后升温至75℃.
b.按一定计量比,Ⅰ、Ⅲ同时加入反应器加水配成溶液,然后加入Ⅱ,再升温到75℃.
c.按一定计量比,将Ⅰ、Ⅱ混合并配成溶液甲,Ⅲ另配成溶液乙,甲、乙同时加热到
75℃,然后将乙溶液缓慢加入甲溶液中,并持续搅拌.
(3)从溶液中分离出ZnFe2(C2O4)3•6H2O需过滤、洗涤.已洗涤完全的依据是取最后一次洗涤滤液,滴入1-2滴盐酸酸化的BaCl2溶液,若不出现白色沉淀,表示已洗净.
(4)ZnFe2(C2O4)3•6H2O热分解需用酒精喷灯,还用到的硅酸盐质仪器有坩埚、泥三角、玻璃棒.
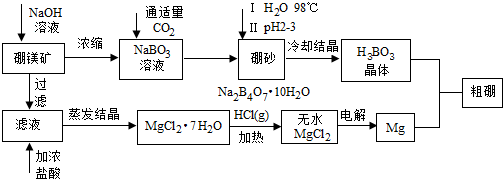
(5)某化学课外小组拟用废旧干电池锌皮(含杂质铁),结合图信息从提供的试剂中选取适当试剂,制取纯净的ZnSO4•7H2O.
实验步骤如下:
①将锌片完全溶于稍过量的3mol•L-1稀硫酸,加入A(选填字母,下同).
A.30%H2O2B.新制氯水 C.FeCl3溶液 D.KSCN溶液
②加入C.
A.纯锌粉B.纯碳酸钙粉末 C.纯ZnO粉末 D.3mol•L-1稀硫酸
③加热到60℃左右并不断搅拌.
④趁热过滤得ZnSO4溶液,再蒸发浓缩、冷却结晶,过滤、洗涤、干燥.
其中步骤③加热的主要目的是促进Fe3+水解转化为沉淀,并使过量的H2O2分解除去.
分析 (1)判断反应是否属于氧化还原反应的依据是:分析有无元素化合价变化;
(2)①由化学式ZnFe2(C2O4)3•6H2O知,Zn2+和Fe2+个数比为1:2;
②由反应(a)知,反应温度75℃,为避免草酸锌、草酸亚铁等副产物的生成,先应将反应物温度都加热到75℃,然后再混合;
(3)从溶液中分离出ZnFe2(C2O4)3•6H2O中含有NH4+、SO42-等杂质离子,可以检验滤液中是否含有SO42-;
(4)根据固体受热分解的实验操作分析;
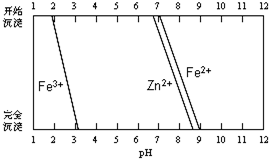
(5)①废旧干电池锌皮(含杂质铁),将锌片完全溶于稍过量的3 mol•L-1稀硫酸,所得溶液中含有杂质离子Fe2+,必须将其除去,结合图象所给信息Zn2+和Fe2+难以分离,必须先将Fe2+氧化为Fe3+再进行分离,为不引进新的杂质,选用30%H2O2作氧化剂;
②分离Zn2+和Fe3+的方法结合图象可用盐类水解原理通过调节pH的方法进行除杂;
③因盐类水解为吸热反应,H2O2受热易分解.
解答 解:(1)判断反应是否属于氧化还原反应的依据是:分析有无元素化合价变化,
反应(a)中无元素化合价变化,不属于氧化还原反应;
反应(b)中铁元素的化合价由+2价变为+3价,碳元素的化合价由-3价部分变为+2价,部分变为+4价,属于氧化还原反应;
故答案为:a;
(2)①由化学式ZnFe2(C2O4)3•6H2O知,Zn2+和Fe2+个数比为1:2,所以称量药品时,必须严格控制n(Fe2+)/n(Zn2+)=2:1;
故答案为:2:1;
②由反应(a)知,反应温度75℃,为避免草酸锌、草酸亚铁等副产物的生成,先应将反应物温度都加热到75℃,然后再混合,选用的加料方式是:按一定计量比,将Ⅰ、Ⅱ混合并配成溶液甲,Ⅲ另配成溶液乙,甲、乙同时加热到75℃,然后将乙溶液缓慢加入甲溶液中,并持续搅拌,故c正确;
故答案为:c;
(3)根据题意知,从溶液中分离出ZnFe2(C2O4)3•6H2O中含有NH4+、SO42-等杂质离子,所以判断晶体已洗涤干净的依据可为:取最后一次洗涤滤液,滴入1~2滴盐酸酸化的BaCl2溶液,若不出现白色沉淀,表示已洗涤完全;
故答案为:取最后一次洗涤滤液,滴入1-2滴盐酸酸化的BaCl2溶液,若不出现白色沉淀,表示已洗净;
(4)ZnFe2(C2O4)3•6H2O热分解实验基本操作为固体的灼烧,用到的仪器有酒精喷灯(或酒精灯)、三脚架、泥三角、坩埚、玻璃棒、坩埚钳等,结合题给要求还用到的硅酸盐质仪器有泥三角、坩埚、玻璃棒;
故答案为:坩埚、泥三角、玻璃棒;
(5)①据题意用废旧干电池锌皮(含杂质铁)制取纯净的ZnSO4溶液实验流程为用硫酸酸溶、除杂.由实验步骤①将锌片完全溶于稍过量的3 mol•L-1稀硫酸发生的反应为Zn+2H+=Zn2++H2↑、Fe+2H+=Fe2++H2↑,所得溶液中含有杂质离子Fe2+,必须将其除去,结合图象所给信息Zn2+和Fe2+难以分离,必须先将Fe2+氧化为Fe3+再进行分离,所以要加过氧化氢氧化亚铁离子;
故答案为:A;
②分离Zn2+和Fe3+的方法结合图象可用盐类水解原理通过调节pH的方法进行除杂,为防止引进杂质可用纯ZnO粉末来调节pH,使Fe3+转化为Fe(OH)3沉淀而除去;
故答案为:C;
③因盐类水解吸热,加热能促进三价铁离子的水解,H2O2受热易分解,所以步骤③加热的主要目的有促进Fe3+水解转化为沉淀,同时使过量的H2O2分解除去;
故答案为:促进Fe3+水解转化为沉淀,并使过量的H2O2分解除去.
点评 本题考查了物质的制备方案设计、物质的分离提纯,把握习题中的信息及发生的化学反应为解答的关键,注意图象及数据的分析与利用,较好的考查学生分析问题、解决问题的能力,题目难度较大.

 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案| A. | 上述同位素中,Ti原子核中的中子数不可能为30 | |
| B. | 题述中包括5种钛原子,即钛元素的5种核素 | |
| C. | 根据题意可求得钛元素的平均相对原子质量为48 | |
| D. | 钛元素属过渡金属元素 |
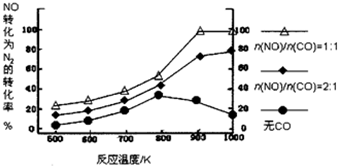
| A. | CO对NO转化为N2起抑制作用 | |
| B. | CO的催化效果随温度升高而提高 | |
| C. | NO的分解反应为放热反应 | |
| D. | $\frac{n(NO)}{n(CO)}$=1时,应控制的最佳温度在1000K |
| A. | 丙炔 | B. | 1-丁炔 | C. | 3-己炔 | D. | 2-庚炔 |
| A. | 银氨溶液 | B. | 溴水 | ||
| C. | 高锰酸钾溶液 | D. | 新制氢氧化铜悬浊液 |