题目内容
【题目】25℃时,改变0.1mol·L-1H2SO3溶液的pH,各微粒的物质的量分数(α)变化如图所示,下列说法中错误的是

A. 1gK1(H2SO3)=-1.9
B. pH=3时,c(HSO3-)>c(H2SO3)>c(SO32-)
C. 反应H2SO3+SO32-![]() 2HSO3-的lgK=5.3
2HSO3-的lgK=5.3
D. pH=7.2时,c(HSO3-)=c(SO32-)=c(H+)
【答案】D
【解析】
结合电离常数表达式可知,图像中的两个交点,可分别计算出K1(H2SO3)=10-1.9和K2(H2SO3)=10-7.2,
A.由分析可知,K1(H2SO3)=10-1.9 ,则1gK1(H2SO3)=-1.9,故A正确;
B. pH=3时,由图可知,c(HSO3-)>c(H2SO3)>c(SO32-),故B正确;
C. 反应H2SO3+SO32-![]() 2HSO3-的K=
2HSO3-的K=![]() =
=![]() =105.3,则lgK=5.3,故C正确;
=105.3,则lgK=5.3,故C正确;
D. pH=7.2时,c(HSO3-)=c(SO32-)>c(H+),故D错误;
答案选D。

 阳光课堂课时作业系列答案
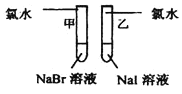
阳光课堂课时作业系列答案【题目】甲同学拟通过实验探究同主族元素性质的递变规律,以及影响化学反应速率的因素。其设计的实验方案如下,请你帮他填写完整,并做出评价。
实验室提供的试剂:锌块、锌粉、铁条、铁粉、铜条、NaBr溶液、NaI溶液、新制的氯水、1mol/盐酸、3mol/L的盐酸
(1)探究同主族元素性质的递变规律
实验步骤 | 实验现象 | 实验结论及离子反应方程式 |
| 甲:___ 乙:___ | 离子反应方程式 甲:___ 乙:___ 结论:卤素单质的氧化性由强到弱的顺序为Cl2>Br2>I2 |
评价:甲同学设计的实验方案的合理性是___(填序号)
A.非常合理 B.完全不合理 C.部分合理
补充和完善:上一项若填A,则此项不用再作答,若填B或C,则完成实验还需要的试剂后,有关反应的离子反应方程式为:___。
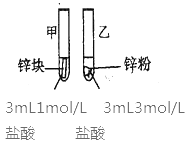
(2)探究影响化学反应速率的因素
实验步骤 | 实验现象 | 实验依据和结论 |
(金属质量相同,盐酸均过量) | 均有气体生成,锌粉先消失,锌块后消失 | 因为乙试管中的反应更快,所以反应物浓度越大,反应速率越快。 |
甲同学所得实验依据和结论有明显问题,问题是___。
(3)请你利用原电池原理,设计实验,比较铜和铁的金属活动性。画出实验装置图,标出正负极、电子流动方向___,写出电极反应式。电极反应式:____、____。
装置图