题目内容
【题目】甲同学拟通过实验探究同主族元素性质的递变规律,以及影响化学反应速率的因素。其设计的实验方案如下,请你帮他填写完整,并做出评价。
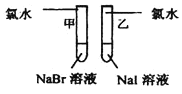
实验室提供的试剂:锌块、锌粉、铁条、铁粉、铜条、NaBr溶液、NaI溶液、新制的氯水、1mol/盐酸、3mol/L的盐酸
(1)探究同主族元素性质的递变规律
实验步骤 | 实验现象 | 实验结论及离子反应方程式 |
| 甲:___ 乙:___ | 离子反应方程式 甲:___ 乙:___ 结论:卤素单质的氧化性由强到弱的顺序为Cl2>Br2>I2 |
评价:甲同学设计的实验方案的合理性是___(填序号)
A.非常合理 B.完全不合理 C.部分合理
补充和完善:上一项若填A,则此项不用再作答,若填B或C,则完成实验还需要的试剂后,有关反应的离子反应方程式为:___。
(2)探究影响化学反应速率的因素
实验步骤 | 实验现象 | 实验依据和结论 |
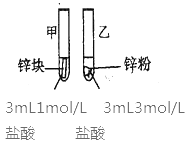
(金属质量相同,盐酸均过量) | 均有气体生成,锌粉先消失,锌块后消失 | 因为乙试管中的反应更快,所以反应物浓度越大,反应速率越快。 |
甲同学所得实验依据和结论有明显问题,问题是___。
(3)请你利用原电池原理,设计实验,比较铜和铁的金属活动性。画出实验装置图,标出正负极、电子流动方向___,写出电极反应式。电极反应式:____、____。
装置图
【答案】溶液由无色变为黄色 溶液由无色变为橙色 2Br-+Cl2=Br2+2Cl- 2I-+Cl2=2Cl-+I2 C Br2+2I-=I2+2Br- 锌粉的表面积大,也能加快反应速率  负极:Fe-2e-=Fe2+ 正极:2H++2e-=H2↑
负极:Fe-2e-=Fe2+ 正极:2H++2e-=H2↑
【解析】
(1)甲试管中加入氯水,溶液中溴离子被氯气氧化成溴单质,溶液由无色变为橙色,反应的离子方程式为:2Br-+Cl2=Br2+2Cl-,乙试管中加入氯水,溶液中的碘离子被氯气氧化成碘单质,溶液由无色变为黄色,反应的离子方程式为:2I-+Cl2=2Cl-+I2,由于乙试管使用的是氯水,无法证明溴单质的氧化性大于碘单质的氧化性,所以甲同学设计的实验方案部分合理,试管乙应该使用溴水,发生的离子方程式为Br2+2I-=I2+2Br-;
(2)两支试管中盐酸的浓度和锌的表面积不同,盐酸的浓度和锌的表面积都影响化学反应速率,所以无法证明浓度对反应速率的影响,正确方法应该将锌都改用同样的规格;
(3)用铁、铜作电极,稀硫酸作电解质溶液设计原电池,铁的金属性比铜强,所以铁作负极,铜作正极,电子从负极沿导线流向正极,原电池装置图为: ;发生的电极反应为:负极:Fe-2e-=Fe2+;正极:2H++2e-=H2↑。
;发生的电极反应为:负极:Fe-2e-=Fe2+;正极:2H++2e-=H2↑。

 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案【题目】下表是元素周期表的一部分,请用化学符号回答有关问题:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | ① | |||||||
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)表中化学性质最不活泼的元素,其原子结构示意图为___。
(2)②、⑧、⑨、⑩四种元素的简单气态氢化物稳定性由强到弱的顺序是___,最高价氧化物的水化物中酸性最强的是___。
(3)第三周期元素形成的简单离子中半径最小的微粒是___,写出该元素的单质分别与⑥、⑩最高价氧化物的水化物反应的离子方程式___、___。
(4)元素③的氢化物的电子式是___;该氢化物与元素⑩的氢化物发生反应的化学方程式___。
(5)用电子式分别写出元素⑨与元素②、⑥形成化合物过程___、___。