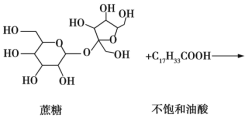
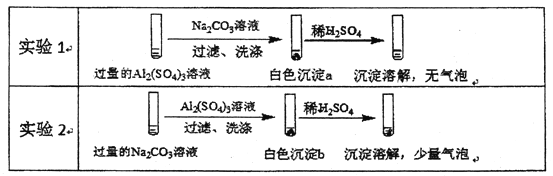
题目内容
【题目】下表是元素周期表的一部分,回答下列问题:
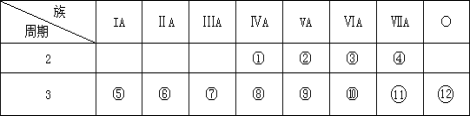
(1)在这些元素中,_____(用元素符号填写,下同)是最活泼的金属元素;_____是最活泼的非金属元素,它们组成的化合物含有的化学键类型为_____。
(2)这些元素的最高价氧化物的对应水化物中_____酸性最强;_____碱性最强;能形成两性氢氧化物的元素是_____。
(3)写出①的最高价氧化物的化学式_____,电子式_____。
(4)③和氢元素组成的化合物中,既含有极性共价键又含有非极性共价键的化合物是_____。
(5)比较⑤与⑥的化学性质,_____更活泼,试用实验证明此现象_____(简述操作、现象和结论)。
【答案】Na F 离子键 HClO4 NaOH Al CO2 ![]() H2O2 Na 金属钠和金属镁的单质分别与冷水反应,钠与冷水剧烈反应,镁与冷水反应很微弱
H2O2 Na 金属钠和金属镁的单质分别与冷水反应,钠与冷水剧烈反应,镁与冷水反应很微弱
【解析】
(1)周期表中,从上到下金属的活泼性逐渐增强,从右到左金属活泼性逐渐增强;稀有气体化学性质稳定;
(2)周期表中,从上到下元素的最高价氧化物对应水化物的碱性逐渐增强,从左到右元素的最高价氧化物对应水化物的酸性逐渐增强;氢氧化铝显两性;
(3)①为碳元素,最高价氧化物为二氧化碳;
(4)③为氧元素,与氢元素组成的化合物中,既含有极性共价键又含有非极性共价键的是过氧化氢;
(5)同周期自左而右金属性减弱,可以利用金属与水的反应进行验证。
(1)根据元素周期表性质的递变规律,最活泼的金属应在第IA,最活泼的非金属应在第VIIA,惰性气体最不活泼,则在IA元素Na最活泼;在VII元素④F最活泼;它们组成的化合物NaF为离子化合物,含有的化学键类型为离子键;
(2)元素的最高价氧化物对应水化物中,酸性最强的必是非金属性最强的,根据同周期、同主族元素非金属性的递变规律可知,元素非金属性最强的是②即F,但F无最高正价。因为我们知道,HClO4是已知的最高价含氧酸中酸性最强的,即酸性最强的是HClO4,元素的最高价氧化物对应水化物中,碱性最强的必是非金属性最强的,根据同周期、同主族元素金属性的递变规律可知,元素金属性最强的是⑤即Na,则碱性最强的必是NaOH,在表中所列元素的最高价氧化物对应水化物中,只有Al(OH)3具有两性,能形成两性氢氧化物的元素是Al元素;
(3)①为碳元素,最高价氧化物为二氧化碳,其化学式为CO2,电子式为![]() ;
;
(4)③为氧元素,与氢元素组成的化合物中,既含有极性共价键又含有非极性共价键的是过氧化氢,化学式为H2O2;
(5)⑤和⑥分别是Na和Mg,根据同主族元素金属性的递变规律可知,金属性Na>Mg,根据判断金属性强弱的方法,可依据二者单质分别与水反应的剧烈程度来判断其金属性强弱,即与H2O反应,故答案为:Na;金属钠和金属镁的单质分别与冷水反应,钠与冷水剧烈反应,镁与冷水反应很微弱。