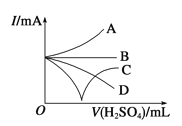
题目内容
【题目】t℃时,在体积不变的密闭容器中发生反应:X(g)+3Y(g)![]() 2Z(g),各组分在不同时刻的浓度如下表:
2Z(g),各组分在不同时刻的浓度如下表:
物质 | X | Y | Z |
初始浓度/(mol·L-1) | 0.1 | 0.2 | 0 |
2min末浓度/(mol·L-1) | 0.08 | a | b |
平衡浓度/(mol·L-1) | 0.05 | 0.05 | 0.1 |
下列说法正确的是
A.平衡时,X的转化率为20%
B.2min时Y的物质的量为0.14
C.增大平衡后的体系压强,v(正)增大,v(逆)减小
D.2min内,用Y的变化量表示的平均反应速率v(Y)=0.03mol·L―1·min―1
【答案】D
【解析】试题分析: X + 3Y![]() 2Z
2Z
初始浓度(molL1) 0.1 0.2 0
转化浓度(molL1)0.05 0.15 0.1
平衡浓度(molL1)0.05 0.05 0.1
A、平衡时,X的转化率=0.05mol/L÷0.1mol/L×100%=50%,A错误;B、2mim消耗X是0.02mol/L,则消耗Y是0.06mol/L,所以剩余Y是0.14mol/L,B错误;C、增大平衡后的体系压强,正反应速率、逆反应速率都增大,C错误;D、前2 min内,用Y的变化量表示的平均反应速率v(Y) =3v(X)=3×(0.1molL1-0.08molL1)÷2min="0.03" mol·L-1·min-1,D正确,答案选D。

【题目】短周期元素 W、X、Y、Z 在元素周期表中的位置如图所示。其中 Z 的单质是一种重要半导体材料,广泛应用于电子工业的各个领域。
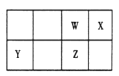
(1)W 在元素周期表中的位置是____________。
(2)W、X、氢元素形成的三原子分子的电子式____________。
(3)下列选项中,能证明元素非金属性X强于W的是____________。
A.相对原子质量:X>W | B.最低化合价:X>W |
C.最简单氢化物的稳定性:X>W | D.最高价氧化物的水化物酸性:X>W |
(4)元素周期表中与 Z 同周期的某金属元素形成的单质 A,可发生如下图所示的转化:
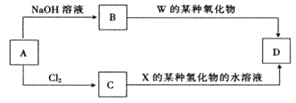
其中化合物D是一种白色沉淀,则 B 中溶质的化学式为____________;
B与 C也可直接转化生成 D 写出对应的离子方程式为____________。