题目内容
10.化合物F(异戊巴比妥)是临床常用的镇静催眠药物,其合成路线如下(部分反应条件和试剂略);
已知:

请回答下列问题:
(1)试剂I的化学名称是乙醇,化合物B的官能团名称是醛基,第④步的化学反应类型是酯化反应或取代反应.
(2)第①步反应的化学方程式是
 +2NaOH$→_{△}^{H_{2}O}$
+2NaOH$→_{△}^{H_{2}O}$ +2NaBr.
+2NaBr.(3)第⑤步反应的化学方程式是
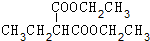 +(CH3)2CHCH2CH2Br+CH3CH2ONa→
+(CH3)2CHCH2CH2Br+CH3CH2ONa→ +CH3CH2OH+NaBr.
+CH3CH2OH+NaBr.(4)试剂Ⅱ的相对分子质量为60,其结构简式是
 .
.(5)化合物B的一种同分异构体G与NaOH溶液共热反应,生成乙醇和化合物H.H在一定条件下发生聚合反应得到高吸水性树脂,该聚合物的结构简式是
 .
.
分析  在氢氧化钠水溶液、加热条件下发生水解反应生成A为
在氢氧化钠水溶液、加热条件下发生水解反应生成A为 ,对比A、B分子式可知,A中羟基被氧化为醛基,则B为
,对比A、B分子式可知,A中羟基被氧化为醛基,则B为 ,B进一步氧化生成C为
,B进一步氧化生成C为 ,C与乙醇发生酯化反应生成D,结合题目信息及F的结构简式,可知D为
,C与乙醇发生酯化反应生成D,结合题目信息及F的结构简式,可知D为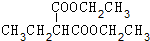 ,E为
,E为 ,试剂Ⅱ为
,试剂Ⅱ为 ,以此来解答.
,以此来解答.
解答 解:(1)试剂Ⅰ为CH3CH2OH,化学名称是:乙醇,化合物B为 ,含有的官能团名称是:醛基,第④步的化学反应类型是:酯化反应或取代反应,
,含有的官能团名称是:醛基,第④步的化学反应类型是:酯化反应或取代反应,
故答案为:乙醇;醛基;酯化反应或取代反应;
(2)第①步反应的化学方程式为 +2NaOH$→_{△}^{H_{2}O}$
+2NaOH$→_{△}^{H_{2}O}$ +2NaBr,
+2NaBr,
故答案为: +2NaOH$→_{△}^{H_{2}O}$
+2NaOH$→_{△}^{H_{2}O}$ +2NaBr;
+2NaBr;
(3)第⑤步反应的化学方程式为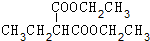 +(CH3)2CHCH2CH2Br+CH3CH2ONa→
+(CH3)2CHCH2CH2Br+CH3CH2ONa→ +CH3CH2OH+NaBr,
+CH3CH2OH+NaBr,
故答案为: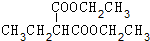 +(CH3)2CHCH2CH2Br+CH3CH2ONa→
+(CH3)2CHCH2CH2Br+CH3CH2ONa→ +CH3CH2OH+NaBr;
+CH3CH2OH+NaBr;
(4)试剂Ⅱ相对分子质量为60,由上述分析可知,其结构简式是 ,故答案为:
,故答案为: ;
;
(5)化合物B( )的一种同分异构体G与NaOH溶液共热反应,生成乙醇和化合物H,H可发生聚合反应,则H的结构简式为CH2=CHCOONa,H在一定条件下发生聚合反应得到高吸水性树脂,该聚合物的结构简式是
)的一种同分异构体G与NaOH溶液共热反应,生成乙醇和化合物H,H可发生聚合反应,则H的结构简式为CH2=CHCOONa,H在一定条件下发生聚合反应得到高吸水性树脂,该聚合物的结构简式是 ,
,
故答案为: .
.
点评 本题考查有机物的合成,为高频考点,把握合成流程中官能团变化、碳原子数变化、有机反应条件及有机反应为解答的关键,侧重分析与应用能力的考查,注意有机物性质的应用,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.下列属于加成反应的是( )
| A. | CCl4+H2$→_{△}^{催化剂}$ CHCl3+HCl | B. | 2CH2=CH2+O2$→_{△}^{催化剂}$2CH3CHO | ||
| C. |  +HNO3$→_{50℃-60℃}^{浓H_{2}SO_{4}}$+H2O+ +HNO3$→_{50℃-60℃}^{浓H_{2}SO_{4}}$+H2O+ | D. |  +3H2$→_{△}^{Ni}$ +3H2$→_{△}^{Ni}$ |
1.下列有关化学用语表示正确的是( )
| A. | 质量数为35的氯原子:35Cl | B. | 氟原子的结构示意图: | ||
| C. | 氯化铵的电子式: | D. | 明矾的化学式:Al2(SO4)3 |
15.电解质的水溶液中存在电离平衡.
(1)醋酸是常见的弱酸.
①醋酸在水溶液中的电离方程式为CH3COOH?H++CH3COO-.
②下列方法中,可以使醋酸稀溶液中CH3COOH电离程度增大的是bc(填字母序号).
a.滴加少量浓盐酸 b.微热溶液
c.加水稀释 d.加入少量醋酸钠晶体
(2)用0.1mol•L-1 NaOH溶液分别滴定体积均为20.00mL、浓度均为0.1mol•L-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线.

①滴定醋酸的曲线是I(填“I”或“Ⅱ”).
②滴定开始前,三种溶液中由水电离出的c(H+)最大的是0.1mol•L-1醋酸溶液.
③V1和V2的关系:V1<V2(填“>”、“=”或“<”).
④M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是c(CH3COO-)>c (Na+)>c (H+)>c (OH-).
(3)为了研究沉淀溶解平衡和沉淀转化,某同学查阅资料并设计如下实验.资料:AgSCN是白色沉淀
①步骤3中现象a是出现白色沉淀.
②写出步骤2中溶液变红色的离子方程式Fe3++3SCN-?Fe(SCN)3.
③用化学平衡原理解释步骤3的实验现象浊液中存在沉淀溶解平衡AgSCN(s)?Ag+(aq)+SCN-(aq),加入KI后,因为溶解度:AgI<AgSCN,Ag+与I-反应生成AgI黄色沉淀:Ag++I-═AgI↓,AgSCN的溶解平衡正向移动.
(1)醋酸是常见的弱酸.
①醋酸在水溶液中的电离方程式为CH3COOH?H++CH3COO-.
②下列方法中,可以使醋酸稀溶液中CH3COOH电离程度增大的是bc(填字母序号).
a.滴加少量浓盐酸 b.微热溶液
c.加水稀释 d.加入少量醋酸钠晶体
(2)用0.1mol•L-1 NaOH溶液分别滴定体积均为20.00mL、浓度均为0.1mol•L-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线.

①滴定醋酸的曲线是I(填“I”或“Ⅱ”).
②滴定开始前,三种溶液中由水电离出的c(H+)最大的是0.1mol•L-1醋酸溶液.
③V1和V2的关系:V1<V2(填“>”、“=”或“<”).
④M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是c(CH3COO-)>c (Na+)>c (H+)>c (OH-).
(3)为了研究沉淀溶解平衡和沉淀转化,某同学查阅资料并设计如下实验.资料:AgSCN是白色沉淀
| 操作步骤 | 现象 |
| 步骤1:向2mL 0.005mol•L-1 AgNO3溶液中加入2mL 0.005mol•L-1 KSCN溶液,静置 | 出现白色沉淀 |
| 步骤2:取1mL上层清液于试管中,滴加1滴2mol•L-1 Fe(NO3)3溶液 | 溶液变红色 |
| 步骤3:向步骤2的溶液中,继续加入5滴3mol•L-1 AgNO3溶液 | 现象a出现白色沉淀,溶液红色变浅 |
| 步骤4:向步骤1余下的浊液中加入5滴3mol•L-1 KI溶液 | 出现黄色沉淀 |
②写出步骤2中溶液变红色的离子方程式Fe3++3SCN-?Fe(SCN)3.
③用化学平衡原理解释步骤3的实验现象浊液中存在沉淀溶解平衡AgSCN(s)?Ag+(aq)+SCN-(aq),加入KI后,因为溶解度:AgI<AgSCN,Ag+与I-反应生成AgI黄色沉淀:Ag++I-═AgI↓,AgSCN的溶解平衡正向移动.
2.回忆初中的电解水实验和高中老师讲的氯碱工业,用石墨作电极电解CuCl2溶液,下列说法正确的是( )
| A. | 阴极上产生红色物质 | B. | 阴极附近溶液呈红色 | ||
| C. | 阴极上产生氯气 | D. | 阳极上产生氢气 |
19.氯化亚铜(CuCl)是白色粉末,微溶于水,能与稀硫酸反应,广泛应用于化工和印染等行业.某研究性学
习小组拟热分解CuC12•2H2O制备CuCl,并进行相关探究(已知酸性条件下Cu+不稳定).

下列说法正确的是( )
习小组拟热分解CuC12•2H2O制备CuCl,并进行相关探究(已知酸性条件下Cu+不稳定).

下列说法正确的是( )
| A. | X气体可以是N2,目的是做保护气,抑制CuCl2•2H2O加热过程可能的水解 | |
| B. | CuCl与稀硫酸反应的离子方程式为:2Cu++4H++SO42-═2Cu2++SO2↑+2H2O | |
| C. | 途径1中产生的Cl2可以回收循环利用,也可以通入饱和CaCl2溶液中除去 | |
| D. | 途径2中200℃下反应的化学方程式为:Cu2(OH)2Cl2$\frac{\underline{\;加热\;}}{\;}$2CuO+2HCl |
20.处于研究阶段的固氮新方法是N2在催化剂表面与水发生如下反应:
(1)已知:2N2(g)+6H2O(1)=4NH3(g)+3O2(g)△H K①
N2(g)+3H2(g)═2NH3(g)△H1=-92.4KJ•mol-1 K1②
2H2(g)+O2(g)═2H2O(l)△H2=-571.6KJ•mol-1 K2③
则△H=+1530kJ•mol-1;K=$\frac{{K}_{{1}^{2}}}{{K}_{{2}^{3}}}$(用K1和K2表示).
(2)在四个容积为2L的密闭容器中,分别充入1molN2、3molH2O,在催化剂条件下进行反应①3小时,实验数据见表:
下列能说明反应①达到平衡状态的是bd(填字母).
a.NH3和O2的物质的量之比为4:3
b.反应混合物中各组分的质量分数不变
c.单位时间内每消耗1molN2的同时生成2molNH3
d.容器内气体密度不变
与第三组相比,每四组反应中NH3的生产量最小的原因可能是催化剂在80℃活性减小,反应速率反而减慢.
(1)已知:2N2(g)+6H2O(1)=4NH3(g)+3O2(g)△H K①
N2(g)+3H2(g)═2NH3(g)△H1=-92.4KJ•mol-1 K1②
2H2(g)+O2(g)═2H2O(l)△H2=-571.6KJ•mol-1 K2③
则△H=+1530kJ•mol-1;K=$\frac{{K}_{{1}^{2}}}{{K}_{{2}^{3}}}$(用K1和K2表示).
(2)在四个容积为2L的密闭容器中,分别充入1molN2、3molH2O,在催化剂条件下进行反应①3小时,实验数据见表:
| 序号 | 第一组 | 第二组 | 第三组 | 第四组 |
| t/℃ | 30 | 40 | 50 | 80 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 | 2.0 |
a.NH3和O2的物质的量之比为4:3
b.反应混合物中各组分的质量分数不变
c.单位时间内每消耗1molN2的同时生成2molNH3
d.容器内气体密度不变
与第三组相比,每四组反应中NH3的生产量最小的原因可能是催化剂在80℃活性减小,反应速率反而减慢.

 T℃时,在容积为0.5L的密闭容器中发生如下反应:mA(g)+nB(g)?pC(g)+qD(s)△H<0(m、n、p、q为最简整数比).A、B、C、D的物质的量变化如图所示.
T℃时,在容积为0.5L的密闭容器中发生如下反应:mA(g)+nB(g)?pC(g)+qD(s)△H<0(m、n、p、q为最简整数比).A、B、C、D的物质的量变化如图所示.