题目内容
20.处于研究阶段的固氮新方法是N2在催化剂表面与水发生如下反应:(1)已知:2N2(g)+6H2O(1)=4NH3(g)+3O2(g)△H K①
N2(g)+3H2(g)═2NH3(g)△H1=-92.4KJ•mol-1 K1②
2H2(g)+O2(g)═2H2O(l)△H2=-571.6KJ•mol-1 K2③
则△H=+1530kJ•mol-1;K=$\frac{{K}_{{1}^{2}}}{{K}_{{2}^{3}}}$(用K1和K2表示).
(2)在四个容积为2L的密闭容器中,分别充入1molN2、3molH2O,在催化剂条件下进行反应①3小时,实验数据见表:
| 序号 | 第一组 | 第二组 | 第三组 | 第四组 |
| t/℃ | 30 | 40 | 50 | 80 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 | 2.0 |
a.NH3和O2的物质的量之比为4:3
b.反应混合物中各组分的质量分数不变
c.单位时间内每消耗1molN2的同时生成2molNH3
d.容器内气体密度不变
与第三组相比,每四组反应中NH3的生产量最小的原因可能是催化剂在80℃活性减小,反应速率反而减慢.
分析 (1)根据盖斯定律①=②×2-③×3,△H=-92.4kJ•mol-1×2+3×571.6kJ•mol-1=+1530kJ•mol-1,平衡常数是利用生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积,结合表达式计算;
(2)化学反应达到化学平衡状态时,正逆反应速率相等,且不等于0,各物质的浓度不再发生变化,由此衍生的一些物理量不发生变化,以此进行判断,得出正确结论;
在反应2N2(g)+6H2O(l)=4NH3(g)+3O2(g)中,
a.NH3和O2的物质的量之比为4:3,反应不一定平衡;
b.反应混合物中各组份的质量分数不变,反应达到平衡;
c.单位时间内每消耗1molN2的同时生成2molNH3,都向正反应方向移动,反应不一定平衡;
d.容器内气体密度逐渐增大,当不变时,反应达到平衡;
第四组温度最高但达平衡时,与第三组相比,氨气的物质的量最小,可能是催化剂在80℃活性减小,反应速率反而减慢.
解答 解:(1)根据盖斯定律①=②×2-③×3,△H=-92.4kJ•mol-1×2+3×571.6kJ•mol-1=+1530kJ•mol-1,根据反应表达式可知平衡常数K=$\frac{{K}_{{1}^{2}}}{{K}_{{2}^{3}}}$,
故答案为:+1530kJ•mol-1;K=$\frac{{K}_{{1}^{2}}}{{K}_{{2}^{3}}}$;
(2)在反应2N2(g)+6H2O(l)=4NH3(g)+3O2(g)中,
a.NH3和O2的物质的量之比为4:3,不是不变的状态,反应不一定平衡,故a错误;
b.反应混合物中各组分的质量分数不变,各物质的浓度不再发生变化,反应达到平衡,故b正确;
c.单位时间内每消耗1molN2的同时生成2molNH3,都向正反应方向移动,无论反应是否平衡,只要进行都满足,故c错误;
d.正反应为气体体积增大的反应,混合气体的密度保持不变,说明气体的物质的量不变,反应达平衡状态,故d正确;
第四组温度最高但达平衡时,与第三组相比,氨气的物质的量最小,可能是催化剂在80℃活性减小,反应速率反而减慢,
故答案为:bd;催化剂在80℃活性减小,反应速率反而减慢.
点评 本题考查盖斯定律,平衡常数计算应用,化学平衡状态,掌握反应特征和平衡移动原理是关键,题目难度中等.

 字词句段篇系列答案
字词句段篇系列答案| A. | 使用铁触媒,加快合成氨反应速率 | B. | 实验室用排饱和食盐水法收集氯气 | ||
| C. | 打开汽水瓶盖,即有大量氕泡逸出 | D. | 温度升高,纯水中的H+浓度增大 |
| A. | 实验室用铜和浓硫酸反应制取硫酸铜 | |
| B. | 实验室用铜和稀硝酸反应制取一氧化氮 | |
| C. | 工业上利用氮气与氢气制取氨气 | |
| D. | 工业上用焦炭还原三氧化二铁制取铁 |
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
 科学家用催化剂将苯酚(X)和1,3-二羰基化合物(Y)合成一种重要的具有生物活性的结构单元--苯并呋喃(Z),W是中间产物(R1、R2均为烃基).则下列有关叙述不正确的是( )
科学家用催化剂将苯酚(X)和1,3-二羰基化合物(Y)合成一种重要的具有生物活性的结构单元--苯并呋喃(Z),W是中间产物(R1、R2均为烃基).则下列有关叙述不正确的是( )| A. | 反应①属于取代反应 | |
| B. | W中有手性碳原子 | |
| C. | 仅使用溴水或FeCl3溶液不能鉴别X和W | |
| D. | X、Y、W、Z都能与NaOH溶液反应、都能使酸性高锰酸钾褪色 |
| A. | ${\;}_{1}^{1}$H和${\;}_{1}^{2}$H互为同位素 | B. | 金刚石和石墨互为同素异形体 | ||
| C. |  和 和  互为同分异构体 互为同分异构体 | D. | CH4和C2H6互为同系物 |


 +2NaOH$→_{△}^{H_{2}O}$
+2NaOH$→_{△}^{H_{2}O}$ +2NaBr.
+2NaBr.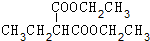 +(CH3)2CHCH2CH2Br+CH3CH2ONa→
+(CH3)2CHCH2CH2Br+CH3CH2ONa→ +CH3CH2OH+NaBr.
+CH3CH2OH+NaBr. .
. .
.
