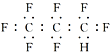题目内容
【题目】有关下列四个常用电化学装置的叙述中正确的是
A.图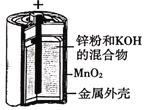 所示电池中,负极电极反应为Zn-2e-=Zn2+
所示电池中,负极电极反应为Zn-2e-=Zn2+
B.图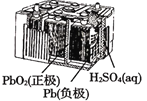 所示电池放电过程中,两电极质量不断增大
所示电池放电过程中,两电极质量不断增大
C.图 所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D.图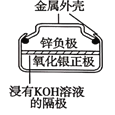 所示电池工作过程中Ag2O被氧化为Ag
所示电池工作过程中Ag2O被氧化为Ag
【答案】B
【解析】
A.该电池反应中由于电解质溶液为碱性,负极的电极反应式为Zn-2e-+2OH-=Zn(OH)2,A错误;
B.铅蓄电池放电时电池反应为:Pb+PbO2+2H2SO4=2PbSO4+2H2O,负极电极反应式为:Pb-2e-+SO42-=PbSO4↓,正极的电极反应式为:PbO2+2e-+4H++SO42-=PbSO4+2H2O,可见:电池放电过程中,两电极质量不断增大,B正确;
C.粗铜中还含有其它金属,电解时,阳极上粗铜中有铜和其它较活泼金属失电子,阴极纯铜上只有铜离子得电子,阴极上析出的铜大于阳极上减少的铜,所以溶液中铜离子浓度降低,C错误;
D.该原电池中,正极上氧化银得电子生成银,所以Ag2O是氧化剂、发生还原反应,D错误;
故合理选项是B。

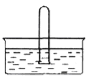
【题目】现有部分短周期元素的原子结构如下表:
元素符号 | 元素原子结构 |
X | 原子结构示意图为 |
Y | 最外层电子数是次外层电子数的2倍 |
Z | 原子核内含有12个中子,且其离子的结构示意图为 |
(1)写出X的元素符号:________,元素Y的最简单氢化物的化学式为_________。
(2)Z元素原子的质量数为_______。
(3)X和Z两种元素的最高价氧化物对应的水化物相互反应的离子方程式为______________________
【题目】I.取一定量的酸性KMnO4溶液依次进行下列实验,有关现象记录如下:①滴加适量H2O2,紫红色褪去,并有气泡产生;②再加入适量的PbO2固体,固体溶解,溶液又变为紫红色; ③最后通入足量的SO2气体。请回答下列问题:
(1)KMnO4、H2O2、PbO2氧化性由强到弱的顺序为________;
(2)实验③中的现象为_____;
(3)实验①中反应的离子方程式是_________________。
(4)要证明某溶液中不含Fe3+而可能含有Fe2+,进行如下实验操作时的最佳顺序为___。
①加入足量氯水 ②加入足量KMnO4溶液 ③加入少量KSCN溶液
A.①③ B.③② C.③① D.①②③
Ⅱ.某工业废水中仅含表中的离子中的5种(不考虑水的电离及离子的水解),且各种离子的物质的量浓度相等,均为0.1mol/L。
阳离子 | K+、Cu2+、Fe3+、 Al3+、Fe2+ |
阴离子 |
|
甲同学欲探究废水的组成,进行了如下实验:
①用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察)。
②取少量溶液,加入KSCN溶液无明显变化。
③另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变。
④向③中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断:
(1)③中加入少量盐酸生成无色气体的离子方程式是____________________。
(2)将③中红棕色气体(标况下)收集满一试管然后倒扣入水中(假设溶质不扩散),所得溶液的物质的量浓度为___________mol/L(精确到千分位)。
(3)甲同学最终确定原溶液中所含离子是__________________。