题目内容
【题目】为倡导“低碳”,减小CO2对环境的影响,需对CO2进行创新利用研究.T1℃使,将将9mol CO2和12mol H2充入3L密闭容器中,发生反应CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H<0,容器中CH3OH的物质的量随时间变化如曲线Ⅰ所示,平衡时容器内压强为p0 . 改变某一条件重新进行上述反应,CH3OH的物质的量随时间变化如曲线Ⅱ所示.下列说法错误的是( ) 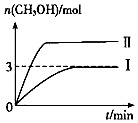
A.曲线Ⅱ对应的条件改变是增大压强
B.T2℃时,上述反应平衡常数为0.52,则T2>T1
C.在T1℃,若起始时向容器充入4.5 mol CO2、6 mol H2 , 平衡时容器内压强P1> ![]()
D.在T1℃,若起始时向容器中充入4.5 mol CO2、5 mol H2、5 mol CH3OH(g)和5 mol H2O(g),则达平衡前v(正)>v(逆)
【答案】B
【解析】解:A.该反应是一个反应前后气体体积减小的放热反应,曲线II到达平衡所需时间较短,说明改变条件时反应速率加快,平衡时甲醇的物质的量增大,说明平衡向正反应方向移动,则改变的条件只能是增大压强,故A正确; B.T1℃时,各物质的平衡浓度分别为:c(CH3OH)=c(H2O)= ![]() =1mol/L,c(CO2)=
=1mol/L,c(CO2)= ![]() =2mol/L,c(H2)=
=2mol/L,c(H2)= ![]() =1mol/L,则平衡常数K=
=1mol/L,则平衡常数K= ![]() =
= ![]() =0.5,T2℃时,上述反应平衡常数为0.52,0.5<0.52,T2℃时平衡常数增大,平衡向正反应方向移动,该反应△H<0,正反应为放热反应,所以T2<T1 , 故B错误;
=0.5,T2℃时,上述反应平衡常数为0.52,0.5<0.52,T2℃时平衡常数增大,平衡向正反应方向移动,该反应△H<0,正反应为放热反应,所以T2<T1 , 故B错误;
C.T1℃时,若起始时向容器由充入4.5molCO2、6mol H2 , 如果转化率相同,则压强是I的一半,实际上,相对于I来说,相当于减小压强,平衡向逆反应方向移动,则压强大于原来的一半,故平衡时容器内压强P1> ![]() ,故C正确;
,故C正确;
D.T1℃时,若起始时向容器中充入 4.5 mol CO2、5 mol H2、5 mol CH3OH(g)和 5 mol H20(g),则各物质的浓度分别为:c(CH3OH)=c(H2O)=c(H2)= ![]() ,c(CO2)=
,c(CO2)= ![]() =1.5,则浓度商=
=1.5,则浓度商=  =0.4<0.5,则平衡向正反应方向移动,则达平衡前v(正)>v(逆),故D正确;
=0.4<0.5,则平衡向正反应方向移动,则达平衡前v(正)>v(逆),故D正确;
故选B.
【考点精析】通过灵活运用化学平衡的计算,掌握反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%即可以解答此题.

 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案