题目内容
向体积和物质的量浓度均相等的盐酸与NaOH溶液中,分别加入足量的铝粉,充分反应后盐酸中产生氢气V1 mL,NaOH溶液中产生氢气V2 mL(体积均在相同条件下测定),下列说法中正确的是( )
①V1=V2
②二者转移电子的物质的量之比为1:3
③反应后的两溶液相混合,铝元素将全部沉淀
④铝与NaOH溶液反应时,H2O作氧化剂.
①V1=V2
②二者转移电子的物质的量之比为1:3
③反应后的两溶液相混合,铝元素将全部沉淀
④铝与NaOH溶液反应时,H2O作氧化剂.
| A、②③ | B、①②③ |
| C、②③④ | D、全部 |
考点:铝的化学性质
专题:几种重要的金属及其化合物
分析:等体积等物质的量浓度,则HCl、NaOH的物质的量相同,由2Al~2NaOH~6HCl~3H2↑计算,以此解答.
解答:
解:等体积等物质的量浓度,则HCl、NaOH的物质的量相同,由2Al~2NaOH~6HCl~3H2↑可知,
①若酸碱均为6mol,则分别与HCl、NaOH反应生成氢气物质的量比为1:3,则V1<V2,故错误;
②生成氢气物质的量比为3:1,由H元素的化合价变化可知,转移电子数不等,二者转移电子的物质的量之比为1:3,故正确;
③与盐酸反应生成Al3+,与NaOH反应生成AlO2-,且物质的量比为1:3,两溶液相混合,铝元素将全部沉淀,故正确;
④铝与NaOH溶液反应时,H2O中H元素的化合价降低,则水作氧化剂,故正确;
故选C.
①若酸碱均为6mol,则分别与HCl、NaOH反应生成氢气物质的量比为1:3,则V1<V2,故错误;
②生成氢气物质的量比为3:1,由H元素的化合价变化可知,转移电子数不等,二者转移电子的物质的量之比为1:3,故正确;
③与盐酸反应生成Al3+,与NaOH反应生成AlO2-,且物质的量比为1:3,两溶液相混合,铝元素将全部沉淀,故正确;
④铝与NaOH溶液反应时,H2O中H元素的化合价降低,则水作氧化剂,故正确;
故选C.
点评:本题考查Al与酸碱反应的计算,侧重学生分析能力和计算能力的考查,注意Al足量时酸碱完全反应为解答的关键,明确存在的关系式,题目难度不大.

练习册系列答案
相关题目
将X气体通入BaCl2溶液,未见沉淀生成,然后通入Y气体,有沉淀生成,X、Y不可能是( )
| 选项 | X | Y |
| A | SO2 | H2S |
| B | Cl2 | CO2 |
| C | NH3 | CO2 |
| D | SO2 | Cl2 |
| A、A | B、B | C、C | D、D |
在呼吸面具和潜水艇里,过滤空气的最佳物质是( )
| A、苛性钠 | B、过氧化钠 |
| C、纯碱 | D、小苏打 |
下列表示溶液中所发生反应的离子方程式正确的是( )
| A、AlCl3溶液与过量氨水混合:Al3++4NH3?H2O═AlO2-+4NH4++2H2O | ||||
| B、偏铝酸钠溶液中通入过量二氧化碳:2AlO2-+CO2+2H2O═2Al(OH)3↓+CO32- | ||||
C、用铜电极做盐酸的导电实验:2H++2Cl-
| ||||
| D、向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42-完全沉淀:2Ba2++NH4++Al3++2SO42-+4OH-═Al(OH)3↓+NH3?H2O+2BaSO4↓ |
以下分子(或离子)①CH4;②NH4+;③CH2Cl2;④P4;⑤CO2;⑥CCl4;⑦H3O+,其结构为正四面体,且键角为109°28′的是( )
| A、①②⑥ | B、①④⑥ |
| C、①③⑥ | D、①②③④⑥ |
实验室用于检验盐酸和其他电离时能产生Cl-的化合物的试剂是( )
| A、稀盐酸和石灰水 |
| B、氢氧化铁 |
| C、氯化钡溶液和稀硝酸 |
| D、硝酸银溶液和稀硝酸 |
有Xn+、Ym+、Zn-三种主族元素的离子,已知它们各自带有的电荷的数值m>n(m,n均为正整数),且X、Y、Z三种原子的M电子层中的电子数均为奇数.若X、Y、Z原子序数依次增加,下列说法中不正确的是( )
| A、它们的最高价氧化物对应的水化物的碱性依次减弱,酸性依次增强 |
| B、三种离子Xn+、Ym+、Zn-具有相同的电子层结构 |
| C、它们都在第三周期 |
| D、X单质有还原性,Z单质具有氧化性 |
aXn-和bYm+是由短周期元素形成的最简单离子,已知Xn-比Ym+多两个电子层,下列说法中正确的是( )
| A、X只能是第三周期元素 |
| B、Y不可能是第二周期元素 |
| C、Y一定是氢元素 |
| D、a-b+n+m等于10或16 |
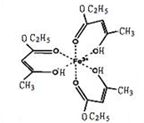 氯化铁溶液用于检验食用香精乙酰乙酸乙酯时,会生成紫色配合物,其配离子结构如图所示.
氯化铁溶液用于检验食用香精乙酰乙酸乙酯时,会生成紫色配合物,其配离子结构如图所示.