题目内容
下列各组物质的变化不能用勒夏特列原理解释的是( )
| A.氯水在光照条件下颜色变浅最终变为无色 |
| B.将FeS固体投入到含有Cu2+的废水中以除去Cu2+ |
| C.500 ℃时比室温更利于合成氨 |
| D.乙酸乙酯的合成中用浓硫酸比稀硫酸更有利于乙酸乙酯的生成 |
C
解析

练习册系列答案
 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案
相关题目
T℃时,在V L恒容密闭容器中加入足量的TaS2(s)和1 mol I2(g),发生反应TaS2(s)+2I2(g) TaI4(g)+S2(g) △H>0。t min时生成0.1 mol TaI4。下列说法正确的是
TaI4(g)+S2(g) △H>0。t min时生成0.1 mol TaI4。下列说法正确的是
A.0~t min内,v(I2)= mol·L-1·min-1 mol·L-1·min-1 |
| B.若T℃时反应的平衡常数K=1,则平衡时I2的转化率为2/3 |
| C.如图制备TaS2晶体过程中循环使用的物质是S2(g) |
| D.图中T1端得到纯净TaS2晶体,则温度T1<T2 |
将N2和H2的混合气体分别充入甲、乙、丙三个容器中进行合成氨反应,经过一段时间后反应速率为:
v甲(H2)=3 mol·L-1·min-1,
v乙(N2)=2 mol·L-1·min-1,
v丙(NH3)=1 mol·L-1·min-1。
这段时间内三个容器中合成氨的反应速率的大小关系为( )
| A.v甲>v乙>v丙 | B.v乙>v甲>v丙 |
| C.v甲>v丙>v乙 | D.v甲=v乙=v丙 |
下列各项不正确的是
| A.等物质的量浓度的下列溶液中① NH4Al(SO4)2② NH4Cl,③CH3COONH4,④ NH3·H2O; c(NH4+),由大到小的顺序是①>②>③>④ |
B.室温下,向0.01mol/L NH4HSO4溶液中滴加NaOH溶液至中性 |
| C.25℃时,0.1mol/LCH3COOH溶液V1 mL和0.1mol/L NaOH溶液V2mL混合,若V1>V2,则混合溶液的pH一定小于7 |
D.对于反应 ,在任何温度下都能自发进行 ,在任何温度下都能自发进行 |
在一个容积为2 L的密闭容器中,加入0.8 mol的A2气体和0.6 mol B2气体,一定条件下发生如下反应:A2(g)+B2(g)  2AB(g) ΔH<0,反应中各物质的浓度随时间的变化情况如图所示,下列说法不正确的是( )
2AB(g) ΔH<0,反应中各物质的浓度随时间的变化情况如图所示,下列说法不正确的是( )
| A.图中a点的值为0.15 |
| B.该反应的平衡常数K=0.03 |
| C.温度升高,平衡常数K值减小 |
| D.平衡时A2的转化率为62.5% |
用纯净的CaCO3与100 mL稀盐酸反应制取CO2,实验过程记录如图所示(CO2的体积已折算为标准状况下的体积),下列分析正确的是( )
| A.OE段表示的平均速率最快 |
| B.EF段,用盐酸表示该反应的平均反应速率为0.4 mol·L-1·min-1 |
| C.OE、EF、FG三段中,该反应用二氧化碳表示的平均反应速率之比为2∶6∶7 |
| D.F点收集到的CO2的量最多 |
下列能确认化学平衡发生了移动的是( )
| A.化学反应速率发生改变 |
| B.有气态物质参加的可逆反应达到平衡后,改变压强 |
| C.由于某一条件的改变,使平衡体系中各组分的浓度发生了不同程度的改变 |
| D.可逆反应达到平衡后,使用催化剂 |
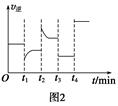
 A. B. C. D.
A. B. C. D. xC(g) ΔH<0,B、C的物质的量随时间变化的关系如图1,达平衡后在t1、t2、t3、t4时都只改变了一种条件,逆反应速率随时间变化的关系如图2。下列有关说法正确的是( )
xC(g) ΔH<0,B、C的物质的量随时间变化的关系如图1,达平衡后在t1、t2、t3、t4时都只改变了一种条件,逆反应速率随时间变化的关系如图2。下列有关说法正确的是( )