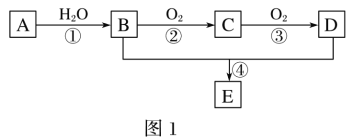
题目内容
【题目】A、B、C、D、E都是短周期元素,原子序数依次增大,A、B处于同一周期,C、D、E同处另一周期。C、B可按原子个数比2:l和1:1分别形成两种离子化合物甲和乙。A原子的最外层电子数比次外层电子数多3个。E是地壳中含量最高的金属元素。根据以上信息回答下列问题:
(1) D元素在周期表中的位置是___________,乙物质的电子式是___________。
(2) A、B、C、D、E五种元素的原子半径由小到大的顺序是_________(用元素符号填写)。
(3) E的单质加入到C的最高价氧化物对应的水化物的溶液中,发生反应的离子方程式是:____________________________。
(4)简述比较D与E金属性强弱的实验方法:_________________________。
【答案】第三周期第ⅡA族 ![]() O<N<Al<Mg<Na 2Al+2OH-+2H2O=2AlO-2+3H2↑ 镁与热水可以反应生成氢氧化镁和氢气,但铝和热水不反应(其他合理也可)
O<N<Al<Mg<Na 2Al+2OH-+2H2O=2AlO-2+3H2↑ 镁与热水可以反应生成氢氧化镁和氢气,但铝和热水不反应(其他合理也可)
【解析】
A、B、C、D、E都是短周期元素原子序数依次增大,C、B可按原子个数比2:1和1:1分別形成两种离子化台物甲和乙,则C为Na,B为O;A、B处于同一周期,且A原子的最外层电子数比次外层电子层多3个,则A为N元素,C、D、E同处另一周期,E是地壳中含量最高的金属元素,则E为Al,所以D为Mg。
(1)D为Mg,位于元素周期表中第三周期第ⅡA族,Na、O以1:1形成离子化合物乙,则乙为Na2O2,其电子式为:![]() ;
;
(2)电子层越多,半径越大,同周期从左向右原子半径在减小,则原子半径为O<N<Al<Mg<Na;
(3)C的最高价氧化物对应的水化物的溶液为NaOH,与A反应的离子反应为2Al+2OH-+2H2O=2AlO-2+3H2↑;
(4)根据金属与热水的反应可确定金属的活泼性,则设计实验为镁与热水可以反应生成氢氧化镁和氢气,但铝和热水不反应,故本题正确答案是:镁与热水可以反应生成氢氧化镁和氢气,但铝和热水不反应(其他合理也可)。

 巧学巧练系列答案
巧学巧练系列答案 课课练江苏系列答案
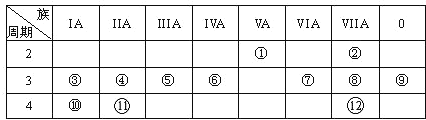
课课练江苏系列答案【题目】下表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白:
IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0族 | |
第二周期 | ① | ② | ③ | |||||
第三周期 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ||
第四周期 | ⑩ |
(1)在这些元素中,化学性质最活泼的是___;化学性质最不活泼的是___(填元素符号)。
(2)在最高价氧化物对应的水化物中,酸性最强的化合物的分子___,④和⑧结合的化合物的电子式是___,该化合物属于___化合物(填“共价”或“离子”)。
(3)③、⑥、⑦三种元素的原子半径由大到小的顺序是___(用化学式表示),⑥、⑦、⑧三种元素的非金属性逐渐___,①、④、⑩三种元素原子还原性逐渐___(填“增强”或“减弱”)。