题目内容
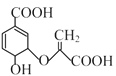
【题目】二甲醚(CH3OCH3)被称为21世纪的新型燃料,25℃,101kPa时呈气态,它清洁、高效、具有优良的环保性能。92g气态二甲醚25℃,101kPa时燃烧放热2910kJ。
(1)当燃烧放热582kJ热量时,转移的电子数为___。
(2)已知H2(g)和C(s)的燃烧热分别是285.8kJ/mol、393.5kJ/mol;计算反应4C(s)+6H2(g)+O2(g)═2CH3OCH3(g)的反应热为__;
(3)工业上利用H2和CO2合成二甲醚的反应如下:6H2(g)+2CO2(g)CH3OCH3(g)+3H2O(g) △H<0
①一定温度下,在一个固定体积的密闭容器中进行该反应,下列能判断反应达到化学平衡状态的是__(选填字母编号)
A.c(H2)与c(H2O)的比值保持不变
B.单位时间内有2molH2消耗时有1molH2O生成
C.容器中气体密度不再改变
D.容器中气体压强不再改变
E.反应产生的热量不再变化
②温度升高,该化学平衡移动后到达新的平衡,CH3OCH3的产量将__(填“变大”、“变小”或“不变”,下同),混合气体的平均摩尔质量将__。
【答案】4.8NA -378.8 kJ/mol ADE 变小 变小
【解析】
92g气态二甲醚25℃,101kPa时燃烧放热2910kJ,则燃烧的热化学方程式为CH3OCH3(g)+3O2(g)==2CO2(g)+3H2O(l) △H= -1455kJ/mol ①
(1)当燃烧放热582kJ热量时,转移的电子数为![]() 。
。
(2)已知H2(g)和C(s)的燃烧热分别是285.8kJ/mol、393.5kJ/mol;
则热化学方程式为C(s)+O2(g)==CO2(g) △H= - 393.5kJ/mol ②
H2(g)+![]() O2(g)=H2O(l) △H= - 285.8kJ/mol ③
O2(g)=H2O(l) △H= - 285.8kJ/mol ③
利用盖斯定律,将②×4+③×6-①×2,即得反应4C(s)+6H2(g)+O2(g)═2CH3OCH3(g)的反应热;
(3)工业上利用H2和CO2合成二甲醚的反应如下:6H2(g)+2CO2(g)CH3OCH3(g)+3H2O(g) △H<0
①A.c(H2)与c(H2O)的比值保持不变,则对题给反应来说,二者的浓度保持不变;
B.单位时间内有2molH2消耗时有1molH2O生成,反应方向相同;
C.气体的质量不变,体积不变,所以容器中气体密度始终不变;
D.反应前后气体分子数不等,容器中气体压强不再改变,反应达平衡;
E.反应产生的热量不再变化,则反应达平衡状态。
②温度升高,平衡逆向移动;混合气体的质量不变,物质的量增大。
92g气态二甲醚25℃,101kPa时燃烧放热2910kJ,则燃烧的热化学方程式为CH3OCH3(g)+3O2(g)==2CO2(g)+3H2O(l) △H= -1455kJ/mol ①
(1)当燃烧放热582kJ热量时,转移的电子数为![]() =4.8NA。答案为:4.8NA;
=4.8NA。答案为:4.8NA;
(2)已知H2(g)和C(s)的燃烧热分别是285.8kJ/mol、393.5kJ/mol;
则热化学方程式为C(s)+O2(g)==CO2(g) △H= - 393.5kJ/mol ②
H2(g)+![]() O2(g)=H2O(l) △H= - 285.8kJ/mol ③
O2(g)=H2O(l) △H= - 285.8kJ/mol ③
利用盖斯定律,将②×4+③×6-①×2,即得反应4C(s)+6H2(g)+O2(g)═2CH3OCH3(g) △H= -378.8kJ/mol。答案为:-378.8 kJ/mol;
(3)工业上利用H2和CO2合成二甲醚的反应如下:6H2(g)+2CO2(g)CH3OCH3(g)+3H2O(g) △H<0
①A.c(H2)与c(H2O)的比值保持不变,则对题给反应来说,二者的浓度保持不变,反应达平衡状态,A符合题意;
B.单位时间内有2molH2消耗时有1molH2O生成,反应方向相同,不一定达平衡状态,B不合题意;
C.气体的质量不变,体积不变,所以容器中气体密度始终不变,反应不一定达平衡状态,C不合题意;
D.反应前后气体分子数不等,容器中气体压强不再改变,反应达平衡状态,D符合题意;
E.反应产生的热量不再变化,则反应达平衡状态,E符合题意;
故选ADE。答案为:ADE;
②温度升高,平衡逆向移动,CH3OCH3的产量将变小;混合气体的质量不变,物质的量增大,则混合气体的平均摩尔质量将变小。答案为:变小;变小。

 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案【题目】无论在办公室还是居室里,在漂亮的花瓶中插上一束美丽的鲜花,将会给紧张而又忙碌的工作、生活带来轻松和愉悦的心情。如果在花瓶中加入“鲜花保鲜剂”,就会延长鲜花的寿命。下表是1L“鲜花保鲜剂”的成分,阅读后回答下列问题:
成分 | 质量(g) | 摩尔质量(g·mol-1) |
蔗糖 | 50.00 | 342 |
硫酸钾 | 0.50 | 174 |
阿司匹林 | 0.35 | 180 |
高锰酸钾 | 0.50 | 158 |
硝酸银 | 0.04 | 170 |
(1)“鲜花保鲜剂”中物质的量浓度最大的成分是________(填写名称)。
(2)“鲜花保鲜剂”中K+的物质的量浓度为(阿司匹林中不含K+)_________(只要求写表达式,不需计算)mol·L-1。
(3)配制过程中,下列操作配制结果没有影响的是________(填字母)。
A.容量瓶在使用前未干燥,里面有少量蒸馏水
B.定容时仰视液面
C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaC1溶液而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
(4)欲确定“鲜花保鲜剂”中硝酸银的浓度,可加入的试剂中含有______。(填化学符号)
【题目】T℃时,将A和B各0.32mol充入恒容密闭容器中,发生反应:A(g)+B(g)![]() 2C(g)△H=-akJ·mol-1(a>0),反应过程中测定的数据如下表,下列说法正确的是( )
2C(g)△H=-akJ·mol-1(a>0),反应过程中测定的数据如下表,下列说法正确的是( )
t/min | 0 | 2 | 4 | 7 | 9 |
n(B)/mol | 0.32 | 0.24 | 0.22 | 0.20 | 0.20 |
A.若起始时向容器中充入0.64molC,则达平衡时吸收的热量为0.12akJ
B.恒温,如果压缩容器体积,B的浓度和体积分数均不变
C.若起始时向容器中充入0.64molA和0.64molB,则达平衡时n(C)<0.40mol
D.恒温、恒容,向平衡体系中再充入0.32molA,再次平衡时,B的转化率增大