题目内容
【题目】下列说法正确的是
A.铅蓄电池放电时,正极每增加96g,转移电子数目为2×6.02×1023
B.反应2Cu+CO2+O2+H2O =Cu2(OH)2CO3在常温下可自发,则该反应ΔH<0
C.常温下,将稀CH3COONa溶液加水稀释后n(H+)·n(OH-)不变
D.保持温度不变,向稀氨水中缓慢通入CO2,溶液中![]() 的值减小
的值减小
【答案】BD
【解析】
A.铅蓄电池放电时,正极反应为PbO2+4H++SO42+2e═PbSO4+2H2O,如1molPbO2参加反应,则质量增加64g,正极增加96g,则有1.5molPbO2参加反应,转移3mol电子,数目为3×6.02×1023,故A错误;
B.如能自发进行,应满足△HT△S<0,反应2Cu+CO2+O2+H2O═Cu2(OH)2CO3,△S<0,在常温下可自发,则该反应△H<0,故B正确;
C.常温下,将醋酸钠稀释后浓度降低,醋酸根离子水解程度增大,但溶液中c(OH)减小,温度不变,离子积常数不变,n(H+)n(OH)=c(H+)V×c(OH)V=Kw×V2,溶液体积增大,所以n(H+)n(OH)增大,故C错误;
D.温度不变电离平衡常数不变,溶液中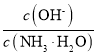 =
=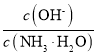 ×
×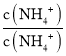 =
=![]() ,通入二氧化碳时,二氧化碳和水反应生成的碳酸和氢氧根离子结合生成水而促进一水合氨电离,使得铵根离子浓度增大,所以
,通入二氧化碳时,二氧化碳和水反应生成的碳酸和氢氧根离子结合生成水而促进一水合氨电离,使得铵根离子浓度增大,所以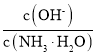 的值减小,故D正确;
的值减小,故D正确;
答案选BD。

【题目】已知X、Y是主族元素,I为电离能,单位是![]() 根据如表所列数据判断,错误的是
根据如表所列数据判断,错误的是
元素 |
|
|
|
|
X | 496 | 4562 | 6912 | 9543 |
Y | 578 | 1817 | 2745 | 11575 |
A. 元素X的常见化合价是![]() 价
价
B. 元素Y是ⅢA族元素
C. X单质的熔点高于Y单质的熔点
D. 若元素X处于第3周期,它的单质可与冷水剧烈反应
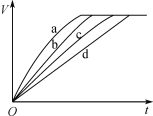
【题目】等质量的铁与过量的盐酸在不同的试验条件下进行反应,测定在不同时间t产生氢气体积V的数据,根据数据绘制得到图甲,则曲线a、b、c、d所对应的试验组别是( )
组别 | c(HCl)(mol·L-1) | 温度(℃) | 铁的状态 |
|
1 | 2.0 | 25 | 块状 | |
2 | 2.5 | 30 | 块状 | |
3 | 2.5 | 50 | 粉末状 | |
4 | 2.5 | 30 | 粉末状 |
A.3-4-2-1B.1-2-4-3C.4-3-2-1D.1-2-3-4