题目内容
碱性电池具有容量大、放电电流大的特点,因此得到广泛的应用.锌锰碱性电池以氢氧化钾溶液为电解液,电池总反应为Zn(s)+2MnO2(s)+H2O═Zn(OH)2(s)+Mn2O3(s),下列说法错误的是( )
| A、电池工作时,锌失去电子 |
| B、电池负极的电极反应式为:Zn-2e-+2OH-═Zn(OH)2 |
| C、电池工作时,电子由正极通外电路流向负极 |
| D、外电路中每通过0.2mol电子,锌的质量理论上减小6.5g |
考点:化学电源新型电池
专题:电化学专题
分析:A、根据原电池原理判断;
B、根据负极上的反应类型书写电极反应式;
C、根据原电池工作原理中电子的流向;
D、根据锌与转移电子的关系计算.
B、根据负极上的反应类型书写电极反应式;
C、根据原电池工作原理中电子的流向;
D、根据锌与转移电子的关系计算.
解答:
解:A、原电池工作原理是:负极失电子,发生氧化反应,故A正确;
B、负极失电子,发生氧化反应,负极的电极反应式为:Zn-2e-+2OH-=Zn(OH)2,故B正确;
C、原电池工作时,电子由负极通外电路流向正极,故C错误;
D、由Zn(s)+2MnO2(s)+H2O(l)═Zn(OH)2(s)+Mn2O3(s)可知,65gZn反应转移电子为2mol,则外电路中每通过0.2mol电子,锌的质量理论上减小6.5g,故D正确;
故选C.
B、负极失电子,发生氧化反应,负极的电极反应式为:Zn-2e-+2OH-=Zn(OH)2,故B正确;
C、原电池工作时,电子由负极通外电路流向正极,故C错误;
D、由Zn(s)+2MnO2(s)+H2O(l)═Zn(OH)2(s)+Mn2O3(s)可知,65gZn反应转移电子为2mol,则外电路中每通过0.2mol电子,锌的质量理论上减小6.5g,故D正确;
故选C.
点评:本题考查了化学电源新型电池,明确原电池原理是解本题关键,难点的电极反应式的书写,要结合电解质溶液的酸碱性书写,难度中等.

练习册系列答案
相关题目
下列叙述,其中正确的是( )
①我国科学家在世界上第一次人工合成结晶牛胰岛索;
②最早发现电子的是英国科学家道尔顿;
③创造“联合制碱法”的是我国著名化学家侯德榜;
④首先制得氧气的是法国科学家拉瓦锡;
⑤首先在实验室合成有机尿素的是俄国的维勒.
①我国科学家在世界上第一次人工合成结晶牛胰岛索;
②最早发现电子的是英国科学家道尔顿;
③创造“联合制碱法”的是我国著名化学家侯德榜;
④首先制得氧气的是法国科学家拉瓦锡;
⑤首先在实验室合成有机尿素的是俄国的维勒.
| A、只有① | B、①和③ |
| C、①②③ | D、①②③④ |
在一定温度下,向容积固定不变的密闭容器中充入a mol A,发生反应:2A(g)?B(g);△H<0.达平衡后再向容器中充入a mol A,再次达到平衡后,与原平衡比较,下列叙述不正确的是( )
| A、相对平均分子质量增大 |
| B、A的转化率提高 |
| C、A的质量分数增大 |
| D、反应放出的总热量大于原来的2倍 |
下列反应中Fe3+离子表现氧化性的是( )
| A、FeCl3溶液滴入沸水中,溶液变为红褐色 |
| B、FeCl3溶液中加入NaOH溶液产生红褐色沉淀 |
| C、FeCl3溶液中加入AgNO3溶液产生白色沉淀 |
| D、FeCl3溶液中通入H2S气体产生浅黄色S沉淀 |
欲使醋酸溶液中的CH3COO-浓度增大,且不放出气体,可向醋酸中加入少量固体( )
| A、NaOH |
| B、NaHCO3 |
| C、Na2CO3 |
| D、Mg |
某氮肥样品可能含有NH4HCO3、NH4Cl、NH4NO3中的一种或几种.称取该样品0.5000g,溶解配成100.00mL溶液,加过量浓NaOH溶液,加热,将产生的氨气通入60.00mL 0.1000mol?L-1的H2SO4溶液中(设产生的NH3全部逸出),剩余的H2SO4溶液能消耗20.00mL 0.2250mol?L-1的NaOH溶液.下列说法正确的是( )
| A、吸收NH3消耗的H2SO4为6.000×10-3mol |
| B、上述过程共产生NH3 268.8mL |
| C、该样品中NH4+的质量分数为43.2% |
| D、该氮肥样品必含NH4Cl |
电化学在日常生活中用途广泛,下图①是镁、次氯酸钠燃料电池的示意图,电池总反应式为:Mg+ClO-+H2O═Cl-+Mg(OH)2↓,图②是含Cr2O72-工业废水的电化学处理示意图.下列说法正确的是( )
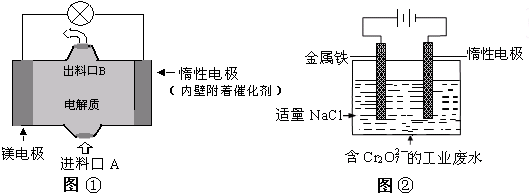

| A、图②中Cr2O72-离子向惰性电极移动,与该极附近的OH-结合转化成Cr(OH)3除去 |
| B、图②中阳极上的电极反应式为:Fe-3e-═Fe3+ |
| C、图①中发生的还原反应是:Mg2++ClO-+H2O+2e-═Cl-+Mg (OH)2↓ |
| D、若图①中3.6g镁溶解产生的电量用以图②废水处理,理论可产生10.7g氢氧化铁沉淀 |
 现有含NH4+、H+、Al3+、Mg2+、Cl-的溶液100mL,往其中逐滴加入2mol/L的氢氧化钠溶液,并不断搅拌,所得沉淀质量与所加氢氧化钠溶液体积的关系如图,其中OA段无气体产生,回答下列问题.
现有含NH4+、H+、Al3+、Mg2+、Cl-的溶液100mL,往其中逐滴加入2mol/L的氢氧化钠溶液,并不断搅拌,所得沉淀质量与所加氢氧化钠溶液体积的关系如图,其中OA段无气体产生,回答下列问题.