题目内容
【题目】甲醇用途日益广泛,越来越引起商家的关注,工业上甲醇的合成途径多种多样。在![]() 密闭容器内,
密闭容器内,![]() 时反应:
时反应:![]()
![]() ,体系中
,体系中![]() 随时间的变化如下表:
随时间的变化如下表:
时间(s) | 0 | 1 | 2 | 3 | 5 |
| 0.020 | 0.011 | 0.008 | 0.007 | 0.007 |
(1)图中表示![]() 的变化的曲线是________。
的变化的曲线是________。
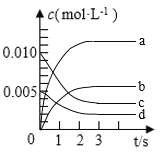
(2)用![]() 表示从0~2s内该反应的平均速率
表示从0~2s内该反应的平均速率![]() ________
________![]() 。
。
(3)能说明该反应已达到平衡状态的是________。
a.![]() 与
与![]() 的浓度保持不变 b.容器内密度保持不变
的浓度保持不变 b.容器内密度保持不变
c.容器内压强保持不变 d.每消耗![]() 的同时有
的同时有![]() 形成
形成
(4)已知常温常压下1g液态甲醇燃烧生成![]() 气体和液态水放出
气体和液态水放出![]() 的热量,则该反应的热化学方程式为________。
的热量,则该反应的热化学方程式为________。
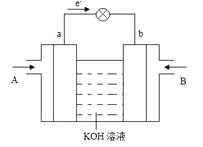
(5)![]() 与
与![]() 的反应可将化学能转化为电能,其工作原理如下图所示,图中
的反应可将化学能转化为电能,其工作原理如下图所示,图中![]() 从________(填A或B)通入。b电极反应式为________。
从________(填A或B)通入。b电极反应式为________。
【答案】b 0.006 a,c ![]()
![]() (1)
(1)![]() A
A ![]()
【解析】
(1)CH3OH是产物,随反应进行浓度增大,平衡时物质的量为CO物质的量的变化量△n(CO);
(2)根据v=![]() 计算v(CO),再利用速率之比等于化学计量数之比计算v(H2);
计算v(CO),再利用速率之比等于化学计量数之比计算v(H2);
(3)当反应达到平衡状态时,正逆反应速率相等,各物质的浓度不再改变,由此衍生的一些物理量也不变;
(4)1g甲醇的物质的量为![]() =
=![]() mol,已知常温常压下1g液态甲醇燃烧生成CO2气体和液态水放出22.68kJ的热量,则1mol甲醇完全燃烧释放的能量为22.68kJ×32=725.76kJ;
mol,已知常温常压下1g液态甲醇燃烧生成CO2气体和液态水放出22.68kJ的热量,则1mol甲醇完全燃烧释放的能量为22.68kJ×32=725.76kJ;
(5)CH3OH与O2的反应可将化学能转化为电能,形成的是原电池反应,甲醇在负极失电子发生氧化反应,正极是氧气得到电子发生还原反应。
(1)CH3OH是产物,随反应进行物质的量增大,平衡时物质的量为CO物质的量的变化量△n(CO),图表中CO的物质的量0-3s变化=0.02mol-0.007mol=0.013mol,所以图象中只有b符合,故答案为:b;
(2)0~2s内CO物质的量变化=0.02mol-0.008mol=0.012mol,v(CO)= =0.003mol/(Ls),v(H2)=2v(CO)=0.006molL-1s-1;
=0.003mol/(Ls),v(H2)=2v(CO)=0.006molL-1s-1;
(3)a.CO和H2的物质的量浓度不变,说明反应达到平衡状态,故a正确;
b.根据质量守恒定律知,混合物质量始终不变,容器的体积不变,则容器内混合气体的密度始终不变,则密度不变,无法判断是否达到平衡状态,故b错误;
c.反应前后气体的总物质的量变化,在恒温恒容条件下,当容器内压强保持不变时,说明气体总物质的量不再改变,此时反应达到平衡状态,故c正确;
d.每消耗1molCH3OH的同时有2molH-H形成,表示反应逆向进行,无法判断反应是否达到平衡状态,故d错误;
故答案为ac;
(4)1g甲醇的物质的量为![]() =
=![]() mol,已知常温常压下1g液态甲醇燃烧生成CO2气体和液态水放出22.68kJ的热量,则1mol甲醇完全燃烧释放的能量为22.68kJ×32=725.76kJ,该反应的热化学方程式为
mol,已知常温常压下1g液态甲醇燃烧生成CO2气体和液态水放出22.68kJ的热量,则1mol甲醇完全燃烧释放的能量为22.68kJ×32=725.76kJ,该反应的热化学方程式为![]()
![]() (1)
(1)![]() ;
;
(5)电子由a流向b说明a为负极,b为正极,CH3OH与O2的反应可将化学能转化为电能,甲醇失电子发生氧化反应,所以CH3OH从A通入,B通入氧气,b电极发生的电极反应为氧气得到电子生成氢氧根离子,电极反应为:O2+4e-+2H2O=4OH-。

 阅读快车系列答案
阅读快车系列答案