题目内容
【题目】(1)下列属于吸热反应的是________;属于放热反应的是________。
①煅烧石灰石 ②木炭燃烧 ③酸碱中和 ④二氧化碳和碳高温反应
(2)![]() 熔点较低,易升华,溶于醇和醚,其与
熔点较低,易升华,溶于醇和醚,其与![]() 化学性质相似。由此可推断
化学性质相似。由此可推断![]() 的化学键是________(填“离子键”或“共价键”),其在固态时属于________(填“原子”、“分子”或“离子”)晶体。
的化学键是________(填“离子键”或“共价键”),其在固态时属于________(填“原子”、“分子”或“离子”)晶体。
【答案】①④ ②③ 共价键 分子晶体
【解析】
(1)①煅烧石灰石是吸热反应;②木炭燃烧是放热反应;③酸碱中和是放热反应;④二氧化碳和碳高温反应是吸热反应;则属于吸热反应的是①④,放热反应的是②③;
(2)BeCl2熔点较低,易升华,溶于醇和醚,其与![]() 化学性质相似,说明BeCl2为分子晶体,可知BeCl2的化学键是共价键。
化学性质相似,说明BeCl2为分子晶体,可知BeCl2的化学键是共价键。

【题目】甲醇用途日益广泛,越来越引起商家的关注,工业上甲醇的合成途径多种多样。在![]() 密闭容器内,
密闭容器内,![]() 时反应:
时反应:![]()
![]() ,体系中
,体系中![]() 随时间的变化如下表:
随时间的变化如下表:
时间(s) | 0 | 1 | 2 | 3 | 5 |
| 0.020 | 0.011 | 0.008 | 0.007 | 0.007 |
(1)图中表示![]() 的变化的曲线是________。
的变化的曲线是________。
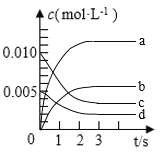
(2)用![]() 表示从0~2s内该反应的平均速率
表示从0~2s内该反应的平均速率![]() ________
________![]() 。
。
(3)能说明该反应已达到平衡状态的是________。
a.![]() 与
与![]() 的浓度保持不变 b.容器内密度保持不变
的浓度保持不变 b.容器内密度保持不变
c.容器内压强保持不变 d.每消耗![]() 的同时有
的同时有![]() 形成
形成
(4)已知常温常压下1g液态甲醇燃烧生成![]() 气体和液态水放出
气体和液态水放出![]() 的热量,则该反应的热化学方程式为________。
的热量,则该反应的热化学方程式为________。
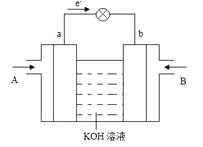
(5)![]() 与
与![]() 的反应可将化学能转化为电能,其工作原理如下图所示,图中
的反应可将化学能转化为电能,其工作原理如下图所示,图中![]() 从________(填A或B)通入。b电极反应式为________。
从________(填A或B)通入。b电极反应式为________。
【题目】金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀而被广泛用作高新科技材料,被誉为“未来金属”。以钛铁矿(主要成分钛酸亚铁)为主要原料冶炼金属钛同时获得副产品甲的工业生产流程如下。请回答下列问题。

(1)钛酸亚铁(用R表示)与碳在高温下反应的化学方程式为2R+C═2Fe+2TiO2+CO2↑,钛酸亚铁的化学式为_______________;钛酸亚铁和浓H2SO4反应的产物之一是TiOSO4,反应中无气体生成,该反应的化学方程式为_____________________________________。
(2)上述生产流程中溶液Ⅰ中含有Fe2+、TiO2+和少量Mg2+等阳离子。常温下,其对应氢氧化物的Ksp如下表所示。
氢氧化物 | Fe(OH)2 | TiO(OH)2 | Mg(OH)2 |
Ksp | 8.0×10-16 | 1.0×10-29 | 1.8×10-11 |
①常温下,若所得溶液中Mg2+的物质的量浓度为0.0018mol/L,当溶液的pH等于_______时,Mg(OH)2开始沉淀。
②若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量白色沉淀,该反应的离子方程式为___________________________________________________________。
(3)中间产品乙与焦炭、氯气在高温下发生反应制取TiCl4的方程式为______________。Mg还原TiCl4过程中必须在1070K的温度下进行,你认为还应该控制的反应条件是_________。
【题目】2SO2(g) + O2(g) ![]() 2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙三个容积均为2 L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示。下列判断中,正确的是
2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙三个容积均为2 L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示。下列判断中,正确的是
甲 | 乙 | 丙 | ||
起始物质的量 | n(SO2) / mol | 0.4 | 0.8 | 0.8 |
n(O2) / mol | 0.24 | 0.24 | 0.48 | |
SO2的平衡转化率 / % | 80 | α1 | α2 | |
A. 甲中反应的平衡常数小于乙
B. 平衡时,丙中c(SO3)是甲中的2倍
C. 该温度下,平衡常数值为400
D. 平衡时,甲中O2的转化率大于乙中O2的转化率

