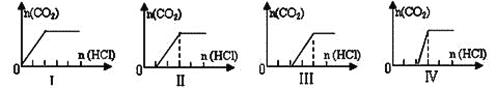
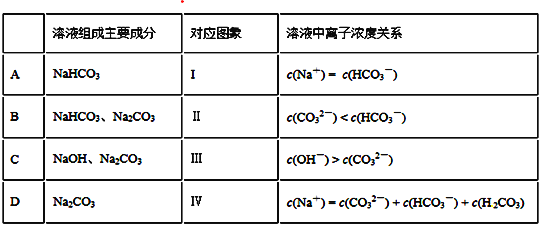
题目内容
【题目】酸性锌锰干电池和碱性锌锰干电池的构造简图如下所示,比较二者的异同,回答下列问题 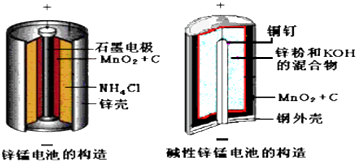
(1)酸性锌锰干电池的负极反应为 .
(2)碱性锌锰干电池在放电过程产生MnOOH,写出正极反应式 .
(3)维持电流强度为0.6A,电池工作10分钟,理论消耗Zng.(结果保留到小数点后两位,F=96500C/mol)
【答案】
(1)Zn﹣2e﹣=Zn2+
(2)MnO2+e﹣+H2O=MnOOH+OH﹣
(3)0.12
【解析】解:(1)酸性锌锰干电池的负极为锌,负极反应为Zn﹣2e﹣=Zn2+ , 所以答案是:Zn﹣2e﹣=Zn2+;(2)在碱性锌锰原电池中,Zn易失电子作负极、二氧化锰作正极,正极上二氧化锰得电子发生还原反应,电极反应式为MnO2+e﹣+H2O=MnOOH+OH﹣ , 所以答案是:MnO2+e﹣+H2O=MnOOH+OH﹣;(3)持电流强度为0.6A,电池工作10分钟,则电量为0.6A×600s=360C,转移电子的物质的量为 ![]() =0.00373mol则消耗Zn的质量为0.00373mol×
=0.00373mol则消耗Zn的质量为0.00373mol× ![]() ×65g/mol=0.12g,所以答案是:0.12.
×65g/mol=0.12g,所以答案是:0.12.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目