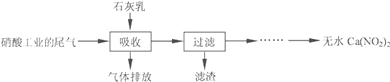
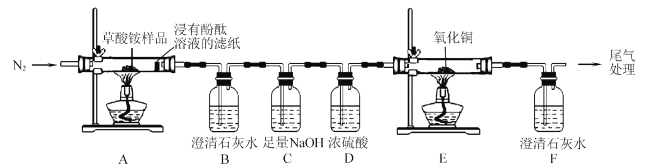
题目内容
【题目】硫的含氧钠盐有许多,现有Na2SO3、Na2S2O3、Na2S2O4(连二亚硫酸钠),其热稳定性比相应的酸强。
已知:2Na2S2O4 =Na2S2O3+Na2SO3+SO2↑
4H++ 2S2O42- = 3SO2↑+ S↓ + 2H2O
完成下列计算:
(1)用Na2S2O3溶液与不同浓度的硫酸反应,可以研究浓度对化学反应速率的影响。现有98%的浓硫酸(密度为1.84g·cm-3)来配制500mL1mol·L(密度为1.06g·cm-3)的稀硫酸,则需要浓硫酸___________mL;加水_______g;
(2)称取部分氧化的亚硫酸钠样品10.16克溶于水,加入稍过量的盐酸酸化了的氯化钡溶液,过滤,洗涤,干燥,所得沉淀质量为2.33克,则该亚硫酸钠中已有_______%(质量分数)的亚硫酸钠被氧化。
(3)现有8.70g的无水Na2S2O4,吸水后得到10.50g Na2S2O4·nH2O,则水合物中n的值是______;
(4)Na2S2O4在500℃时部分分解得产物A,将9.16g产物A中加入足量的稀硫酸中,生成SO21.568L(标准状况),试确定残留物中钠、硫和氧的原子个数比_______;若取另一份Na2S2O4部分分解得到的产物B,则ag产物B中钠、硫和氧的原子个数比为__________(范围)。
【答案】27.2mL 480 12.6% 2 6:5:10 4:3:6到1:1:2之间
【解析】
(1)先根据c=![]() 计算浓硫酸的浓度,再根据浓硫酸稀释前后溶质的物质的量不变计算浓硫酸的体积;根据稀硫酸溶液的质量=浓硫酸溶液的质量+水的质量来计算溶剂质量;
计算浓硫酸的浓度,再根据浓硫酸稀释前后溶质的物质的量不变计算浓硫酸的体积;根据稀硫酸溶液的质量=浓硫酸溶液的质量+水的质量来计算溶剂质量;
(2)加入稍过量的盐酸酸化了的氯化钡溶液,所得沉淀质量为2.33克,即为硫酸钡的质量,根据硫酸根离子守恒以及化学反应原理来计算;
(3)8.70g的无水Na2S2O4物质的量是0.05mol,吸水后得到10.50g Na2S2O4nH2O,所以0.05molNa2S2O4nH2O中水的质量是10.5g-8.7g=1.8g,据此计算;
(4)2Na2S2O4→Na2S2O3+Na2SO3+SO2↑,4H++2S2O42-→3SO2↑+S↓+2H2O,其中Na2S2O3和Na2SO3物质的量分别为x,结合质量守恒和化学方程式定量关系列式计算,另一份Na2S2O4部分分解得到的产物B,则ag产物能是未分解,也可能是全部分解,据此计算。
(1)质量分数为98%、密度为1.84gcm-3的浓硫酸物质的量浓度为![]() =18.4mol/L,配制溶液时,稀释前后溶质的物质的量不变,设浓硫酸的体积为V,所以18.4mol/L×V=1molL-1×0.5L,解得:V=0.0272L=27.2mL,500mL1molL(密度为1.06gcm-3)的稀硫酸溶液的质量=浓硫酸的质量+水的质量,设加水的质量是m,则27.2mL×1.84gcm-3+m=500mL×1.06gcm-3,解得m=480g,故答案为:27.2;480;
=18.4mol/L,配制溶液时,稀释前后溶质的物质的量不变,设浓硫酸的体积为V,所以18.4mol/L×V=1molL-1×0.5L,解得:V=0.0272L=27.2mL,500mL1molL(密度为1.06gcm-3)的稀硫酸溶液的质量=浓硫酸的质量+水的质量,设加水的质量是m,则27.2mL×1.84gcm-3+m=500mL×1.06gcm-3,解得m=480g,故答案为:27.2;480;
(2)加入稍过量的盐酸酸化了的氯化钡溶液,所得沉淀为硫酸钡,质量为2.33g物质的量为![]() =0.01mol,所以被氧化的亚硫酸钠是0.01mol,被氧化亚硫酸钠的质量分数=
=0.01mol,所以被氧化的亚硫酸钠是0.01mol,被氧化亚硫酸钠的质量分数=![]() ×100%=12.6%,故答案为:12.6%;
×100%=12.6%,故答案为:12.6%;
(3)8.70g的无水Na2S2O4,物质的量是![]() =0.05mol,吸水后得到10.50g Na2S2O4nH2O,则水合物中n的值是
=0.05mol,吸水后得到10.50g Na2S2O4nH2O,则水合物中n的值是![]() ×
×![]() =2,故答案为:2;
=2,故答案为:2;
(4)将9.16g产物A中加入足量的稀硫酸中,生成SO21.568L(标准状况)物质的量n=![]() =0.07mol,2Na2S2O4→Na2S2O3+Na2SO3+SO2↑,4H++2S2O42-→3SO2↑+S↓+2H2O,设部分分解后的产物中Na2S2O3和Na2SO3物质的量分别为x,未分解的Na2S2O4 物质的量为y,
=0.07mol,2Na2S2O4→Na2S2O3+Na2SO3+SO2↑,4H++2S2O42-→3SO2↑+S↓+2H2O,设部分分解后的产物中Na2S2O3和Na2SO3物质的量分别为x,未分解的Na2S2O4 物质的量为y,
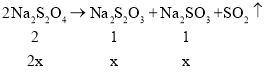
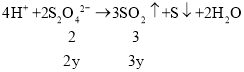
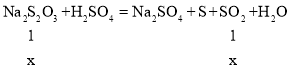
![]()
①1.5y+2x=0.07,②158x+126x+174y=9.16。由①和②解得:x=0.02mol,y=0.02mol;则残留物0.02molNa2S2O4、0.02molNa2S2O3、0.02molNa2SO3中钠、硫和氧的原子个数比为6∶5∶10;另一份Na2S2O4部分分解得到的产物B,则ag产物则ag产物能是未分解,也可能是全部分解,未分解则为Na2S2O4、B中钠、硫和氧的原子个数比为1∶1∶2,如全部分解为等物质的量的Na2S2O3和Na2SO3,钠、硫和氧的原子个数比为4∶3∶6,故答案为:6∶5∶10;4∶3∶6到1∶1∶2之间。