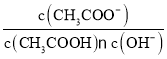题目内容
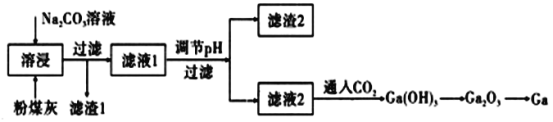
【题目】硫酸的工业制备是一个重要的化工生产过程,但同时在生产过程中会产生大量SO2等污染物。以硫酸工业的尾气、氨水、石灰石、焦炭及氯化钾为原料可以合成有重要用途的硫化钙、硫酸钾、氯化铵、亚硫酸铵等物质。合成路线如下:

完成下列填空:
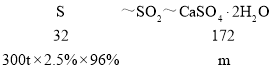
(1)某电厂每月用煤300t(煤中含硫的质量分数为2.5%),若燃烧时煤中的硫全部转化为二氧化硫,现用反应Ⅰ的原理将尾气中的SO2转化为石膏,且反应过程中96%的硫转化为石膏,则可生产石膏______ t。
(2)操作a中,必须的操作步骤有蒸发、___________、___________等;
(3)反应Ⅲ中氧化剂与还原剂的物质的量之比为__________;
(4)写出反应Ⅳ的方程式______________ ;操作b所得滤液中阳离子的检验方法是________________。
(5)反应Ⅴ在25℃,40%乙二醇溶液中进行,该复分解反应能顺利进行的原因是___________;
(6)该生产过程中可以循环使用的物质是_______________。
【答案】38.7 冷却结晶 过滤 1:4 CaSO4+2NH3+CO2+H2O=(NH4)2SO4+CaCO3↓ 取溶液少许加入NaOH并加热,生成有刺激性气味的气体能使湿润的红色石蕊试纸变蓝 由于K2SO4在乙二醇溶液中的溶解度小,能够形成晶体而析出,因此符合复分解反应发生的条件 CaCO3,CO2
【解析】
由流程可知,I中发生的反应为2CaCO3+O2+2SO2=2CaSO4+2CO2,反应Ⅳ为CaSO4、NH3和CO2反应生成碳酸钙和硫酸铵,发生CO2+2NH3+CaSO4+H2O =CaCO3↓+(NH4)2SO4,可知CaCO3、CO2可循环使用,反应Ⅴ为硫酸铵溶液中加入氯化钾生成硫酸钾晶体,所以操作b为过滤,滤液中含有的阳离子为铵根离子,Ⅱ中发生SO2+2NH3·H2O=(NH4)2SO3+H2O,Ⅲ中发生CaSO4+4C=CaS+4CO↑,据此分析解答。
(1)二氧化硫与碳酸钙反应生成亚硫酸钙与二氧化碳,反应方程式为:SO2+CaCO3=CaSO3+CO2,亚硫酸钙在水存在的条件下被氧气氧化生成CaSO42H2O,反应方程式为:2CaSO3+O2+4H2O=2(CaSO42H2O),总反应为:2CaCO3+2SO2+O2+4H2O═2(CaSO42H2O)+2CO2,因此有
![]() =
=![]() ,解得:m=38.7t,故答案为:38.7;
,解得:m=38.7t,故答案为:38.7;
(2)操作a是从亚硫酸铵溶液中获得亚硫酸铵晶体,亚硫酸铵晶体受热易分解,所以操作a为冷却结晶、过滤,故答案为:冷却结晶;过滤;
(3)反应Ⅲ的化学方程式为:CaSO4+4C=CaS+4CO↑,其中氧化剂为CaSO4,还原剂为C,反应中氧化剂与还原剂的物质的量之比为1∶4,故答案为:1∶4;
(4)反应Ⅳ的化学方程式为CaSO4+2NH3+CO2+H2O=(NH4)2SO4+CaCO3↓,操作b过滤,所得滤液中阳离子为铵根离子,具有铵根离子的方法为:取溶液少许加入NaOH并加热,生成有刺激性气味的气体,并能使湿润的红色石蕊试纸变蓝,故答案为:CaSO4+2NH3+CO2+H2O=(NH4)2SO4+CaCO3↓;取溶液少许加入NaOH并加热,生成有刺激性气味的气体,并能使湿润的红色石蕊试纸变蓝;
(5)反应V中选用了40%的乙二醇溶液,温度控制在25℃,是因为乙二醇能够降低硫酸钾的溶解度,有利于硫酸钾析出,故答案为:由于K2SO4在乙二醇溶液中的溶解度小,能够形成晶体而析出,因此符合复分解反应发生的条件;
(6)根据上面的分析可知,该生产过程中可以循环使用的物质为CaCO3,CO2,故答案为:CaCO3,CO2.