题目内容
【题目】科学处理NOx、SO2等大气污染物,对改善人们的生存环境具有重要的现实意义。
(1)利用甲烷催化还原氮氧化物。已知:
CH4(g) +4NO2(g) =4NO(g)+CO2(g) +2H2O(g);△H=-574kJmol-1
CH4(g)+2NO2(g)=N2(g) +CO2(g)+2H2O(g);△H=-867kJmol-1
则CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H=____________________
(2)利用氧化氮氧化物的流程如下:
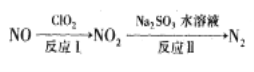
已知反应I的化学方程式为2NO+ClO2+H2O=NO2+HNO3+HCl,若反应I中转移3mol电子,则反应Ⅱ中可生成N2的体积为_____L(标准状况下)。
(3)常温下,用NaOH溶液吸收SO2得到pH=9的Na2SO3溶液,吸收过程中水的电离程度_____(填“增大”、“减小”或“不变”);请写出Na2SO3溶液中,c(Na+)、c(H2SO3)、c(SO32-)、c(HSO3-)的大小关系:_____。
(4)利用Fe2(SO4)3溶液也可处理SO2废气,所得Fe2+溶液有很多重要用途。保存1.8molL﹣1的FeSO4溶液时,为防止溶液中Fe2+被氧化,常加入_____;为确保溶液中不出现浑浊,应调节溶液的pH不超过_____。(常温下,Ksp[Fe(OH) 2]=1.8×10﹣16)
【答案】﹣1160 kJmol-1 6.72 增大 c(Na+)>c(SO32-)>c(HSO3-)>c(H2SO3) 铁粉 6
【解析】
(1)①CH4(g) +4NO2(g) =4NO(g)+CO2(g) +2H2O(g);△H=-574kJ·mol-1,②CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g);△H=-867kJ·mol-1,③CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g),根据推出:2×②-①得出:△H=(-867×2+574)kJ·mol-1=-1160kJ·mol-1;
(2)反应II中发生的反应方程式为2NO2+4Na2SO3=N2+4Na2SO4,反应I中转移电子数与反应II中生成N2的物质的量的关系为:5mole-~NO2~0.5molN2,因此反应I中转移3mol电子,则反应II中可生成N2的体积为3×0.5×22.4/5L=6.72L;
(3)NaOH抑制水的电离,反应后生成Na2SO3,SO32-发生水解反应,促进水的电离,因此吸收过程中水的电离程度增大;Na2SO3溶液中:SO32-+H2O![]() HSO3-+OH-、HSO3-+H2O
HSO3-+OH-、HSO3-+H2O![]() H2SO3+OH-,水解的程度微弱,第一步水解为主,因此微粒浓度大小顺序是c(Na+)>c(SO32-)>c(HSO3-)>c(H2SO3);
H2SO3+OH-,水解的程度微弱,第一步水解为主,因此微粒浓度大小顺序是c(Na+)>c(SO32-)>c(HSO3-)>c(H2SO3);
(4)为防止Fe2+被氧化,不引入新的杂质,同时又因为Fe+2Fe3+=3Fe2+,因此往往常加入铁粉或铁屑;氢氧化铁达到饱和,c(OH-)=![]() mol·L-1=1×10-8mol·L-1,则pH不超过6。
mol·L-1=1×10-8mol·L-1,则pH不超过6。

【题目】化学反应原理在科研和生产中有广泛应用,根据题意回答下列问题:
I工业上制备Na2S的反应原理如下
①Na2SO4(s)===Na2S(s)+2O2(g) △H1=+1011.0kJ·mol-1
②C(s)+O2(g)===CO2(g) △H2=-393.5kJ·mol-1
③2C(s)+O2(g)===2CO(g) △H3=-221.0kJ·mol-1
④Na2SO4(s)+4C(s)===Na2S(s)+4CO(g) △H4
(1)△H4=___________ kJ·mol-1。
(2)反应④能自发进行的条件是___________。
(3)工业上制备Na2S不用反应①,而用反应④的理由是_____________________________。
Ⅱ.在一定温度下,向某恒容密闭容器中充入等物质的量的NO和CO发生反应:2NO(g)+2C0(g) ![]() 2CO2(g)+N2(B) △H=-748kJ/mo1。用气体传感器测得不同时间NO的浓度如下:
2CO2(g)+N2(B) △H=-748kJ/mo1。用气体传感器测得不同时间NO的浓度如下:
时间(s) | 0 | 10 | 20 | 30 | 40 | …… |
C(NO)/mol/L | 0.100 | 0.050 | 0.025 | 0.010 | 0.010 | …… |
(1)计算此温度下该反应的K=______________________。
(2)达到平衡时,下列措施能提高NO转化率的是___________(填序号)。
A.选用更有效的催化剂
B.降低反应体系的温度
C.充入氩气使容器内压强增大
D.充入CO使容器内压强增大
Ⅲ.工业上常用臭氧处理含NO2-的废水。
(1)O3氧化NO2-可产生NO3-和O2,反应中每生成1mol的O2转移___________mol电子。
(2)O3可由电解稀硝酸制得,原理如图。图中阴极为___________(填“A”或“B”),阳极(惰性电极)的电极反应式为____________________________________________。

【题目】某学生用0.200 0 mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴处充满液体;
③调节液面至“0”或“0”刻度线以下,并记下读数;
④移取20.00 mL待测液注入洁净的还存有少量蒸馏水的锥形瓶中,并加入3滴酚酞溶液;
⑤用标准液滴定至终点,记下滴定管液面读数。
请回答下列问题:
(1)以上步骤有错误的是______(填编号)。若测定结果偏高,其原因可能是________(填字母)。
A.配制标准溶液的固体NaOH中混有KOH杂质
B.滴定终点读数时,仰视滴定管的刻度,其他操作正确
C.盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗
D.所配的标准NaOH溶液物质的量浓度偏大
(2)判断滴定终点的现象是_____________________________________。
(3)如图是某次滴定时的滴定管中的液面,其读数为________mL。

(4)根据下列数据,请计算待测盐酸的浓度:________mol·L-1。
滴定次数 | 待测体积(mL) | 标准烧碱溶液体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 20.00 | 0.40 | 20.40 |
第二次 | 20.00 | 2.00 | 24.10 |
第三次 | 20.00 | 4.00 | 24.00 |

