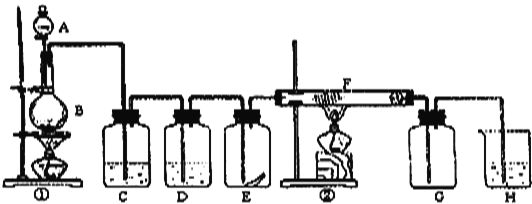
题目内容
【题目】氢气在氧气中燃烧时产生淡蓝色火焰.在反应过程中,破坏1mol氢气中的化学键消耗的能量为Q1kJ,破坏1mol O2中的化学键消耗的能量为Q2 kJ,形成1mol H2O中的化学键释放的能量为Q3 kJ.下列关系式中,正确的是
A. Q1+Q2>Q3B. 2Q1+Q2>2Q3
C. 2Q1+Q2<2Q3D. Q1+Q2<2Q3
【答案】C
【解析】
破坏1molH-H消耗的能量为Q1kJ,则H-H键能为Q1kJ/mol,破坏1molO═O键消耗的能量为Q2kJ,则O═O键键能为Q2kJ/mol,形成1mol水中的化学键释放的能量为Q3kJ,每摩尔H2O中含有2molH-O键,1molH-O键释放的能量为![]() Q3kJ,则H-O键能为
Q3kJ,则H-O键能为![]() Q3kJ/mol,对于反应2H2(g)+O2(g)═2H2O(l)反应热△H=反应物的总键能-生成物的总键能,故:反应热△H=2Q1kJ/mol+Q2kJ/mol-4×
Q3kJ/mol,对于反应2H2(g)+O2(g)═2H2O(l)反应热△H=反应物的总键能-生成物的总键能,故:反应热△H=2Q1kJ/mol+Q2kJ/mol-4×![]() Q3kJ/mol=(2Q1+Q2-2Q3)kJ/mol,由于氢气在氧气中燃烧,反应热△H<0,即(2Q1+Q2-2Q3)<0,所以2Q1+Q2<2Q3,故答案为C。
Q3kJ/mol=(2Q1+Q2-2Q3)kJ/mol,由于氢气在氧气中燃烧,反应热△H<0,即(2Q1+Q2-2Q3)<0,所以2Q1+Q2<2Q3,故答案为C。

练习册系列答案
相关题目