题目内容
【题目】根据如图填空:
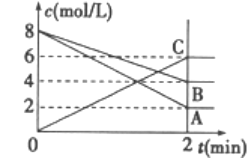
(1)反应物是______________,生成物是______________。
(2)在2 min内用A、B、C表示的化学反应速率分别为____________、____________、____________。
(3)该反应的化学方程式是____________________________。
【答案】A、B C 3 mol/(L·min) 2 mol/(L·min) 3 mol/(L·min) 3A+2B![]() 3C
3C
【解析】
(1)由图像的变化可知A、B的浓度是减小的,而C的浓度是增加的,则反应物为A、B,生成物为C,故答案为:A、B;C。(2)在2min内有ν(A)=(8-2)mol/L÷2min=3 mol/(L·min),ν(B)=(8-4)mol/L÷2min=2 mol/(L·min),ν(C)=6mol/L÷2min=3 mol/(L·min),故答案为:3 mol/(L·min)、2 mol/(L·min)、3 mol/(L·min);(3)由于反应进行2min后处于平衡状态,则反应为可逆反应,且ν(A):ν(B):ν(C)=3:2:3,则方程式中A、B、C三种物质前的系数依次为3、2、3,故答案为:3A+2B![]() 3C。
3C。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】活性炭可处理大气污染物NO。T℃时,在1L密闭容器中加入NO气体和炭粉,发生反应生成两种气体A和B,测得各物质的物质的量如下:
活性炭/mol | NO/mol | A/mol | B/mol | |
起始状态 | 2.030 | 0.100 | 0 | 0 |
2 min时 | 2.000 | 0.040 | 0.030 | 0.030 |
(1)2 min内,用NO表示该反应的平均速率v(NO)= mol·L-1·min-1;
(2)该反应的化学方程式是________________________________________;
(3)一定条件下,在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是_____ 。
①v(NO)∶v(A)∶v(B)=2∶1∶1
②混合气体的密度不再改变
③总压强不再改变
④混合气体的平均相对分子质量不再改变
(4)碳元素可形成数量众多,分布极广的有机化合物,其中甲醇是常见的燃料,甲醇燃料电池的结构示意图如下,一极通入甲醇,另外一极通入氧气;电解质溶液是稀硫酸,电池工作时总反应式:2CH3OH+3O2=2CO2+4H2O。

①a处通入的物质是____,电极反应式为:______;
②b处电极反应式为_________________________;
③电池工作时H+由 极移向 极(填正、负极)。



