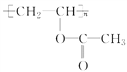
题目内容
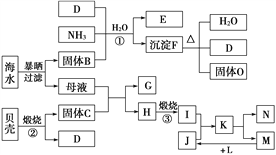
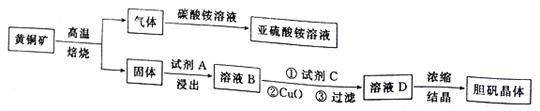
【题目】下图是以黄铜矿(主要成分为CuFeS2)为原料制取胆矾晶体的流程:
已知:
ⅰ.高温焙烧时的主要反应有:2CuFeS2+O2![]() Cu2S+2FeS+SO2
Cu2S+2FeS+SO2
2Cu2S+ 5O2![]() 2CuO+2CuSO4,2FeS+3O2
2CuO+2CuSO4,2FeS+3O2![]() 2FeO+2SO2 ;
2FeO+2SO2 ;
ⅱ.常温下Ksp[Fe(OH)3]=8.0×10-38,Ksp[Cu(OH)2]=3.0×10-20。
(1)CuFeS2中硫元素的化合价为______________________,写出上述流程中生成亚硫酸铵的化学方程式:______________________________________________________________________。
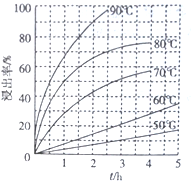
(2)最适合的试剂A是__________(写化学式)溶液;当试剂A的浓度为6.0mol·L-1时 ,“浸出”实验中,铜的浸出率结果如下图所示。由图可知,当铜的浸出率为90% 时,所采用的实验条件(温度、时间)为__________。
(3)最适合的试剂C是__________(填标号)。
a.Cl2b. H2O2 溶液 c.酸性高锰酸钾溶液 d.浓硫酸
(4)加入适量CuO粉末的作用是调节溶液的pH,促进Fe3+水解,达到除杂的目的。写出实现该目的的总反应的离子方程式:_________________________________________________________。
(5)有同学怀疑CuO不一定能达到上述目的,而小张同学却认为可以通过计算来确定。设溶液中Cu2+的浓度为3.0 mol·L-1,则Cu2+开始沉淀时溶液的pH 为__________,Fe3+沉淀完全时溶液的pH 为__________。通过计算判断加入CuO__________(填“能”或“不能”)达到目的(提示:1g 5=0.7;通常认为残留在溶液中的某离子浓度小于1.0×10-5 mol·L-1 时,就认为该离子已沉淀完全)。
(6)假设流程图中消耗的CuO为ag,最终制得bg胆矾晶体,消耗黄铜矿的质量为cg,不考虑生产过程中的损失,则黄铜矿中CuFeS2的质量分数为__________(写出原始的计算结果即可,不必化简)。
【答案】 -2 SO2+(NH4)2CO3=(NH4)2SO3+CO2 H2SO4 90℃、2 h b 2Fe3++3CuO+3H2O=2Fe(OH)3+3Cu2+ 4.0 3.0 能  ×100%
×100%
【解析】(1)CuFeS2中铜的化合价为+2价,铁的化合价为+2价,根据元素化合价代数和为零可知硫的化合价为-2价;上述流程中黄铜矿高温焙烧产生的气体是二氧化硫,二氧化硫与碳酸铵反应生成亚硫酸铵和二氧化碳,反应的化学方程式为:SO2+(NH4)2CO3=(NH4)2SO3+CO2;(2)以黄铜矿为原料制取胆矾晶体,焙烧后生成的氧化物必须先用硫酸溶解,故最适合的试剂A是H2SO4;由图中信息可知,当铜的浸出率为90% 时,所采用的实验条件(温度、时间)为:90℃、2h;(3)试剂C是将溶液B中的亚铁离子氧化为铁离子,在加入氧化铜调节pH值后水解转化为沉淀而除去铁,最适合的试剂C是H2O2 溶液,将亚铁离子氧化为铁离子的同时产生水,没有引入新的杂质,答案选b;(4)加入适量CuO粉末的作用是调节溶液的pH,促进Fe3+水解生成氢氧化铁,同时氧化铜溶解生成Cu2+,达到除杂的目的。实现该目的的总反应的离子方程式为:2Fe3++3CuO+3H2O=2Fe(OH)3+3Cu2+;(5)常温下Ksp[Cu(OH)2]=c(Cu2+)c2(OH-)=3.0 mol·L-1×c2(OH-)=3.0×10-20,则c(OH-)=1.0×10-10,c(H+)=1.0×10-4,pH=4.0,即Cu2+开始沉淀时溶液的pH 为4.0;通常认为残留在溶液中的某离子浓度小于1.0×10-5 mol·L-1 时,就认为该离子已沉淀完全,Ksp[Fe(OH)3] =c(Fe3+)c3(OH-)=1.0×10-5 mol·L-1×c3(OH-)=8.0×10-38,则c(OH-)=1.0×10-11,c(H+)=1.0×10-3,pH=3.0,由于Cu2+开始沉淀时溶液的pH 为4.0,Fe3+沉淀完全时溶液的pH 为3.0,加入CuO能达到目的;(6)根据铜的质量守恒黄铜矿和加入的氧化铜中的铜的总质量先于胆矾晶体中铜的总质量,黄铜矿中CuFeS2的质量分数为x,则有:cg×x×![]() +ag×
+ag×![]() =bg,解得x=
=bg,解得x=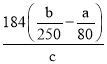 ×100%。
×100%。