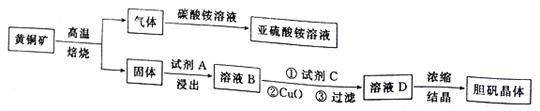
题目内容
【题目】硼氢化钠(NaBH4)在化工等领域具有重要的应用价值,某研究小组采用偏硼酸钠NaBO2为主要原料制备NaBH4 , 其流程如下: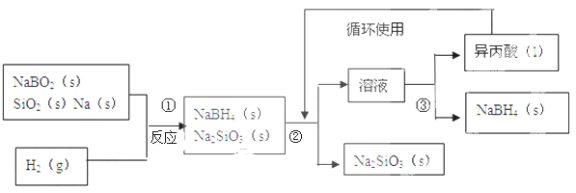
已知:NaBH4常温下能与水反应,可溶于异丙酸(沸点:33℃)。
(1)在第①步反应加料之前,需要将反应器加热至100℃以上并通入氩气,该操作的目的是 ,原料中的金属钠通常保存在 中,实验室取用少量金属钠需要用到的实验用品有 , ,玻璃片和小刀等;
(2)请配平第①步反应的化学方程式: NaBO2+ SiO2+ Na+ H2=NaBH4+2Na2SiO3;
(3)第②步分离采用的方法是 ;第③步分离(NaBH4)并回收溶剂,采用的方法是 .
(4)NaBH4(s)与H2O(l)反应生成NaBO2(s)和H2(g),在25℃,101KPa下,已知每消耗3.8克NaBH4(s)放热21.6KJ,该反应的热化学方程式是 。
【答案】
(1)除去反应器中的水蒸气和空气;煤油;镊子;滤纸
(2)1;2;4;2
(3)过滤;蒸馏
(4)NaBH4 ( s)+2 H2O(1)=NaBO2 ( s) +4H2(g) △H=-216. 0KJ/mol
【解析】(1)由于NaBH4常温下能与水反应,且Na比较活泼,加执到100度以上,充入氩气,是除去反应器中的水蒸气和空气,避免影响反应:少量金属钠保存在煤油里:取用钠时,用镊子夹取,滤纸吸干表面的煤油;(2)根据氧化还原反应原理,得失电子总相同,可以配平此反应为:![]() +2
+2![]() +4Na+2
+4Na+2![]() =
=![]() +
+![]() ;( 3 )从流程图中可以看出第②步分离的是适体和液体混合物,所以选用过滤的方法:第③步分离(
;( 3 )从流程图中可以看出第②步分离的是适体和液体混合物,所以选用过滤的方法:第③步分离(![]() )并回收溶剂,只能先将溶剂蒸发再冷凝回收,即蒸馏的方法分离;(4)根据物质的量计算,n(
)并回收溶剂,只能先将溶剂蒸发再冷凝回收,即蒸馏的方法分离;(4)根据物质的量计算,n(![]() )=0.1mol,.故热方程式为: NaBH4 ( s) +2 H2O(1)=NaBO2 ( s) +4H2(g) △H=-216. 0KJ/mol;
)=0.1mol,.故热方程式为: NaBH4 ( s) +2 H2O(1)=NaBO2 ( s) +4H2(g) △H=-216. 0KJ/mol;
【考点精析】通过灵活运用化学实验操作的先后顺序,掌握化学实验顺序遵循:“从下往上”原则;“从左到右”原则;先“塞”后“定”原则;“固体先放”原则;“液体后加”原则;先验气密性(装入药品前进行)原则;后点酒精灯(所有装置完毕后再点酒精灯)原则即可以解答此题.

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案