题目内容
将ag Mg、Al合金完全溶解在V1L、c1mol/L的盐酸溶液中,产生bgH2。再向反应后的溶液中加入V2L,c2mol/LNaOH溶液,恰好使沉淀达到最大值,且沉淀质量为dg。则下列关系式错误的是( )
| A.合金中的物质的量为(24b-a)/9mol |
| B.d=a+17b |
C.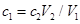 |
D.与金属反应后剩余盐酸的物质的量浓度为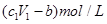 |
A、D
解析试题分析:A、设n(Mg)=xmol, n(Al)=ymol,
则有:24x+27y=a;x+1.5y=b/2
解之得: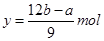
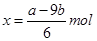
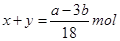
B、生成的沉淀的质量为氢氧化镁跟氢氧化铝的质量的和:也等于镁和铝的质量再加上氢氧根离子的质量,而氢氧根离子的质量在这里等于氢氧根离子的物质的量那氢氧根离子的摩尔质量之积,氢氧根离子的物质的量等于在这个反应过程中镁跟铝反应时所失去的电子的物质的量,又等于反应过程中酸中的氢所得到的电子的物质的量,也就是说氢氧根离子的物质的量等于氢气的物质的量的二倍。所以有如下关系:d=a+17b
C、在这个过程中后边加的氢氧化钠可以理解为是刚好跟前面加的盐酸进行中和反应。因此它们二者的物质的量相等,有: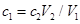
D、与金属反应后剩余盐酸的物质的量浓度为: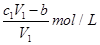
考点:镁、铝的性质。

 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案 走进文言文系列答案
走进文言文系列答案将2.3 g金属钠放入100 g水中,完全反应后溶质的质量分数为( )
A.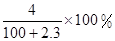 | B.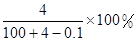 |
C.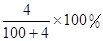 | D.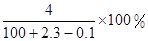 |
用一小粒钠投入水中,实验操作和过程中不可能感知或观察到的现象是
| A.钠的熔点低 | B.钠呈银白色、硬度小 |
| C.钠有延展性,导电性好 | D.钠具有强还原性 |
将ag镁铝合金投入到x mL 2mol/L的盐酸中,金属完全溶解后,再加入y mL 1mol/L的氢氧化钠溶液,得到的沉淀量最大,质量为(a+1.7)g。下列说法不正确的是
| A.镁铝合金与盐酸反应转移电子总数为0.lNA | B.x=2y |
| C.沉淀是Mg(OH)2和Al(OH)3的混合物 | D.2x=y |
有a、b、c、d、e五种金属。已知:a、c均能与稀硫酸反应放出气体;b能与d的硝酸盐反应,置换出d单质;c与强碱溶液反应放出气体;c、e在冷浓硫酸中发生钝化。由此可判断a、b、c、d、e依次是( )
| A.Al、Cu、Ag、Mg、Fe | B.Fe、Cu、Al、Ag、Mg |
| C.Mg、Cu、Al、Ag、Fe | D.Mg、Ag、Al、Cu、Fe |
(16分)钢铁企业酸洗钢材时产生的废液主要成分为Fe2+、H+、Cl-,可用下述方法处理该废液,回收盐酸和制备氧化铁涂料。 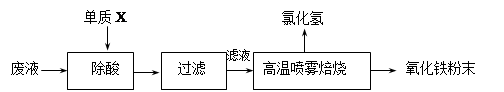
(1)单质X的化学式是 。
(2)氯化亚铁溶液经高温喷雾焙烧转化为HCl气体和氧化铁粉末,有关的化学方程式依次为: 。
(3)某铁红涂料中除含有Fe2O3外,还可能添加有CuO或FeO中的一种,请设计实验方案,探究该铁红涂料中添加物的成分。
① 提出合理假设
假设1:添加了CuO
假设2:添加了FeO
② 请设计方案,验证上述假设,写出实验步骤、预期现象和结论。
限选试剂:铁粉、3mol?L-1H2SO4、0.1 mol?L-1酸性KMnO4溶液、10%NaOH溶液、10%H2O2、KSCN溶液
| 操作步骤 | 预期现象和结论 |
| 步骤1.取少量样品于试管中, ____________________________________________ | 样品全部溶解,得到澄清的溶液。 |
| 步骤2. 步骤3. | ___________________________ ___________________________ |
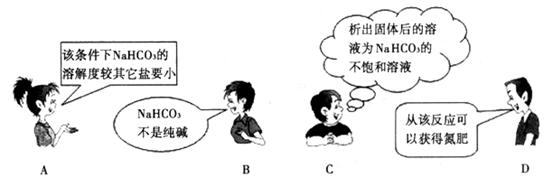
 ”是“侯氏制碱法”的重要反应。下面是4位同学对该反应涉及的有关知识发表的部分见解。其中不正确的是
”是“侯氏制碱法”的重要反应。下面是4位同学对该反应涉及的有关知识发表的部分见解。其中不正确的是