题目内容
将2.3 g金属钠放入100 g水中,完全反应后溶质的质量分数为( )
A.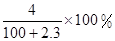 | B.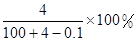 |
C.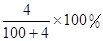 | D.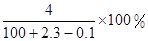 |
D
解析试题分析:金属钠与水反应:2Na+2H2O=2NaOH+H2↑.钠的物质的量为0.1mol,产生的氢氧化钠的物质的量也是0.1mol,质量是4g.溶液的质量是水的质量加钠的质量减去氢气的质量:100+2.3-0.1=102.2g.所以溶液中溶质的质量分数是D.
考点:考查金属钠与水反应后溶质的质量分数的计算问题的知识。

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
铝分别与足量的稀硫酸和氢氧化钠溶液反应,当两个反应放出的气体在相同状况下体积相等时,反应中消耗的硫酸和NaOH物质的量之比为
| A.1:1 | B.3:1 | C.3:2 | D.1:3 |
下列有关实验操作的叙述正确的是( )
| A.将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中 |
| B.某气体能使湿润的红色石蕊试纸变蓝,该气体水溶液一定显碱性 |
| C.NaCl 溶液蒸发结晶时,蒸发皿中刚好有晶体析出时即停止加热 |
| D.向AlCl3溶液中滴加氨水,会产生白色沉淀,再加入NaHSO4溶液,沉淀不消失 |
为了除去FeCl2溶液中混有的少量FeCl3,最好的方法是向此溶液中
| A.通入氯气 | B.加入Zn | C.加入Fe | D.加入Cu |
向一定量的饱和NaOH溶液中加入少量Na2O固体,恢复到原来温度时,下列说法中正确的是( )
| A.溶液中的Na+总数不变 | B.溶液中的OH-数目不变 |
| C.溶质的物质的量浓度不变 | D.溶液的质量不变 |
向100mL2mol/L的NaOH溶液中通入一定量的CO2,结晶,得到9.3g白色固体,该白色固体的组成是
| A.只含Na2CO3 | B.只含NaHCO3 |
| C.NaOH和Na2CO3的混合物 | D.Na2CO3和NaHCO3的混合物 |
有相同质量的两份NaHCO3粉末,第一份加入足量盐酸,笫二份先加热使其完全分解
再加足量同质量分数的盐酸,则两者所消耗的盐酸中氯化氢的质量比为
| A.2:1 | B.1:1 | C.1:2 | D.4:2 |
等量的铁分别与足量的盐酸、水蒸气在一定的条件下充分反应,则在相同的条件下,产生氢气的体积比是
| A.1:1 | B.3:4 | C.2:3 | D.4:3 |
将ag Mg、Al合金完全溶解在V1L、c1mol/L的盐酸溶液中,产生bgH2。再向反应后的溶液中加入V2L,c2mol/LNaOH溶液,恰好使沉淀达到最大值,且沉淀质量为dg。则下列关系式错误的是( )
| A.合金中的物质的量为(24b-a)/9mol |
| B.d=a+17b |
C.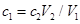 |
D.与金属反应后剩余盐酸的物质的量浓度为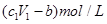 |