题目内容
【题目】乙烯与乙烷的混合气体共amol,与bmol氧气共存于一密闭容器中,点燃后充分反应,乙烯和乙烷全部消耗完,得到CO和CO2的混合气体和45g水,则下列说法错误的是( )
A.当a=1时,乙烯和乙烷的物质的量之比为1:1
B.当a=1时,且反应后CO和CO2的混合气体的物质的量为反应前氧气的 ![]() 时,则b=3
时,则b=3
C.当a=1时,且反应后CO和CO2的混合气体的物质的量为反应前氧气的 ![]() 时,则CO和CO2的物质的量之比为3:1
时,则CO和CO2的物质的量之比为3:1
D.a的取值范围为 ![]() <a<
<a< ![]()
【答案】C
【解析】解:A.设乙烯与乙烷的物质的量分别为xmol、ymol,根据二者物质的量之和与H原子守恒列方程,则:x+y=1,4x+6y= ![]() ×2,解得:x=0.5,y=0.5,故n(C2H4):n(C2H6)=0.5mol:0.5mol=1:1,故A正确;
×2,解得:x=0.5,y=0.5,故n(C2H4):n(C2H6)=0.5mol:0.5mol=1:1,故A正确;
B.根据碳元素守恒可知,反应后CO和CO2混合气体的物质的量之和为1mol×2=2mol,故 ![]() b=2,解得:b=3,故B正确;
b=2,解得:b=3,故B正确;
C.设反应后CO和CO2的物质的量分别为amol、bmol,根据二者之和与氧原子守恒列方程,则:a+b=2,a+2b=3×2﹣ ![]() ,解得:a=0.5,b=1.5,故n(CO):n(CO2)=0.5mol:1.5mol=1:3,故C错误;
,解得:a=0.5,b=1.5,故n(CO):n(CO2)=0.5mol:1.5mol=1:3,故C错误;
D.生成水的物质的量= ![]() mol=2.5mol,只有乙烯时,a值最大,根据H原子守恒可知,a的极大值为:
mol=2.5mol,只有乙烯时,a值最大,根据H原子守恒可知,a的极大值为: ![]() =
= ![]() mol,只有乙烷时,a值最小,根据H原子守恒可知,a的极小值为:
mol,只有乙烷时,a值最小,根据H原子守恒可知,a的极小值为: ![]() =
= ![]() mol,故a的取值范围为:
mol,故a的取值范围为: ![]() <a<
<a< ![]() ,故D正确;
,故D正确;
故选C.

【题目】下列四个试管中,发生如下反应:Zn+2HCl=ZnCl2+H2↑,产生H2的反应速率最小的是( )
试管 | 盐酸浓度 | 温度 | 锌的状态 |
A | 0.5molL﹣1 | 20℃ | 块 状 |
B | 0.5molL﹣1 | 20℃ | 粉末状 |
C | 2molL﹣1 | 35℃ | 块 状 |
D | 2molL﹣1 | 35℃ | 粉末状 |
A.A
B.B
C.C
D.D
【题目】为了达到下表所列的实验目的,请选择合适的实验方法,将其标号填入对应的空格中.
实验目的 | 实验方法 |
证明地瓜粉中有淀粉 | |
检验酒精中是否含有水 | |
证明NaOH溶液呈碱性 | |
除去FeCl2溶液中少量的FeCl3 |
实验方法:
A.加入足量铁粉,过滤
B.碘水
C.无水硫酸铜粉末
D.滴入酚酞试液.
【题目】硝基苯是重要的精细化工原料,是医药和染料的中间体,还可做有机溶剂.制备硝基苯的过程如下: ①配制混酸:组装如图反应装置.取100 mL烧杯,用20 mL浓硫酸与浓硝酸18 mL配制混和酸,加入漏斗中.把18 mL苯加入三颈烧瓶中.
②向室温下的苯中逐滴加入混酸,边滴边搅拌,混和均匀.
③在50﹣60℃下发生反应,直至反应结束.
④除去混和酸后,粗产品依次用蒸馏水和10%Na2CO3溶液洗涤,最后再用蒸馏水洗涤得到粗产品.已知
(i) ![]() +HNO3(浓)
+HNO3(浓) ![]()
![]() +H2O
+H2O 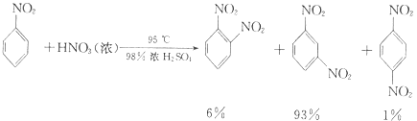
(ii)可能用到的有关数据列表如下
物质 | 熔点/℃ | 沸点/℃ | 密度(20℃)/gcm﹣3 | 溶解性 |
苯 | 5.5 | 80 | 0.88 | 微溶于水 |
硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
1,3﹣二硝基苯 | 89 | 301 | 1.57 | 微溶于水 |
浓硝酸 | 83 | 1.4 | 易溶于水 | |
浓硫酸 | 338 | 1.84 | 易溶于水 |
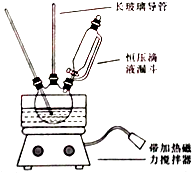
请回答下列问题:
(1)配置混酸应先在烧杯中先加入 .
(2)恒压滴液漏斗的优点是 .
(3)实验装置中长玻璃管可用代替(填仪器名称).
(4)反应结束后产品在液体的层(填“上”或者“下”),分离混酸和产品的操作方法为
(5)用10%Na2CO3溶液洗涤之后再用蒸馏水洗涤时,怎样验证液体已洗净? .
(6)为了得到更纯净的硝基苯,还须先向液体中加入除去水,然后蒸馏,最终得到17.5g硝基苯,则硝基苯的产率为(保留两位有效数字).若加热后,发现未加沸石,应采取的操作是 .