题目内容
【题目】“低碳循环”引起各国的高度重视,而如何降低大气中![]() 的的含量及有效地开发利用
的的含量及有效地开发利用![]() ,也正成为科学家研究的主要课题。利用
,也正成为科学家研究的主要课题。利用![]() 直接加氢合成二甲醚包括以下三个相互联系的反应。
直接加氢合成二甲醚包括以下三个相互联系的反应。
I甲醇的合成![]()
II甲醇脱水![]()
Ⅲ逆水汽变换![]()
已知:相关物质变化的焓变示意图如下:
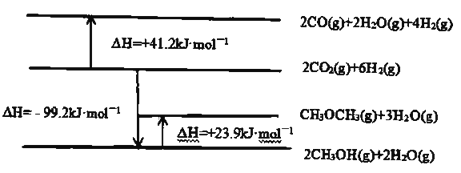
(1)请写出![]() 直接加氢合成二甲醚的热化学方程式:________________。
直接加氢合成二甲醚的热化学方程式:________________。
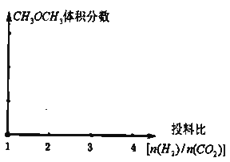
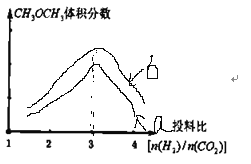
(2)保持恒温恒容的条件,当a充入![]() 、b充入
、b充入![]() ,在其他条件不变时,请在下图中分别画出平衡时
,在其他条件不变时,请在下图中分别画出平衡时![]() 的体积分数随投料比
的体积分数随投料比![]() 变化的曲线图,请用a、b标注曲线图。_________
变化的曲线图,请用a、b标注曲线图。_________
(3)在恒容密闭容器里按体积比为![]() 充入二氧化碳和氢气,一定条件下反应达到平衡状态。当改变反应的某一个条件后,下列变化能说明平衡一定向逆反应方向移动的是________________。
充入二氧化碳和氢气,一定条件下反应达到平衡状态。当改变反应的某一个条件后,下列变化能说明平衡一定向逆反应方向移动的是________________。
A.正反应速率先增大后减小
B.逆反应速率先增大后减小
C.化学平衡常数K值增大
D.反应物的体积分数增大
(4)温度、压强对反应中![]() 平衡转化率和二甲醚的选择性的影响如下图1,图2:
平衡转化率和二甲醚的选择性的影响如下图1,图2:
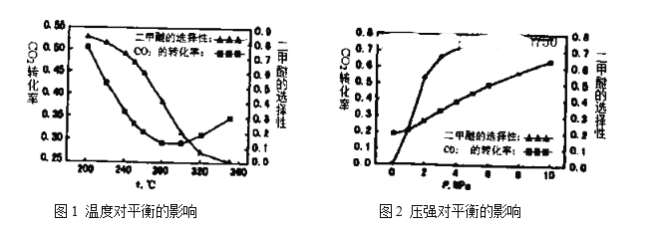
①根据图1,下列说法正确的是________。
A.温度较高时,反应以逆水汽变换反应为主,温度升高,反应速率加快,所以![]() 转化率增大
转化率增大
B.温度较低时,反应以合成二甲醚为主,正反应放热,升高温度,![]() 平衡转化率降低
平衡转化率降低
C.由图像可知,![]() 加氢合成二甲醚应该选择具有良好的低温活性的催化剂
加氢合成二甲醚应该选择具有良好的低温活性的催化剂
D.由图像可知,高温有利于逆水汽变换反应,而不利于二甲醚的生成
②根据图2可知:随着压强升高,![]() 平衡转化率和二甲醚的选择性都增大,分析原因:__________。
平衡转化率和二甲醚的选择性都增大,分析原因:__________。
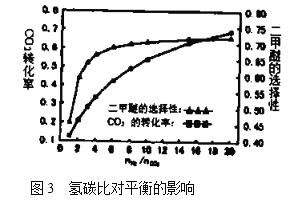
(5)在![]() ,压强为3.0MPa的反应条件下,氢碳比
,压强为3.0MPa的反应条件下,氢碳比![]() 对
对![]() 转化率和二甲醚选择性的影响见图3.分析实际工业生产中制备二甲醚选择氢碳比在3~6之间的原因:________________。
转化率和二甲醚选择性的影响见图3.分析实际工业生产中制备二甲醚选择氢碳比在3~6之间的原因:________________。
【答案】![]()
![]()
 B BCD 反应
B BCD 反应![]() 为减压反应,随着压强升高反应正移,
为减压反应,随着压强升高反应正移,![]() 平衡转化率和二甲醚的选择性都增大 可提高产物的纯度,提高原料的利用率
平衡转化率和二甲醚的选择性都增大 可提高产物的纯度,提高原料的利用率
【解析】
(1)根据盖斯定律计算热化学方程式;
(2)根据热化学方式判断投料比![]() 的最值,再利用平衡移动判断1molCO2和2molCO2
的最值,再利用平衡移动判断1molCO2和2molCO2![]() 体积分数变化;
体积分数变化;
(3)利用勒夏特列原理判断平衡移动方向;
(4)由图一可知,反应温度较低时CO2转化率较高,二甲醚选择性较高,反应主要乙生成二甲醚为主,该反应为放热反应,温度升高反应逆移CO2转化率下降,温度较高时反应主要以逆水汽变换反应为主,反应为吸热反应,温度升高反应正移CO2转化率升高;由图二可知:随着压强升高,![]() 平衡转化率和二甲醚的选择性都增大,反应以生成二甲醚为主,压强升高反应正移二氧化碳转化率增大;
平衡转化率和二甲醚的选择性都增大,反应以生成二甲醚为主,压强升高反应正移二氧化碳转化率增大;
(5)由图可知氢碳比![]() 在3~6之间二甲醚的选择性较大,反应主要以生成二甲醚为主,二氧化碳转化率随着氢碳比
在3~6之间二甲醚的选择性较大,反应主要以生成二甲醚为主,二氧化碳转化率随着氢碳比![]() 的增大而增大。
的增大而增大。
(1)由焓变示意图可知![]()
![]()
![]()
![]() 由2①+②可得
由2①+②可得![]()
![]() ,故答案为:
,故答案为:![]()
![]() ;
;
(2)由方程式![]() 可知当投料比
可知当投料比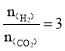 时,
时,![]() 体积分数最大,CO2投入增加平衡正移
体积分数最大,CO2投入增加平衡正移![]() 体积分数增大,故可得曲线图
体积分数增大,故可得曲线图 ,故答案为:
,故答案为: ;
;
(3)A. 增大反应物浓度,平衡正向移动,正反应速率先增大后减小,不一定逆向移动,故A错误;
B. 逆反应速率先增大后减小,说明平衡逆向移动,故B正确;
C. 化学平衡常数K值增大,说明平衡正向移动,故C错误;
D. 反应物的体积百分含量增大,说明平衡正向移动,故D错误;
故答案选:B。
(4)①A.温度较高时,反应以逆水汽变换反应为主,正反应为吸热反应,温度升高,平衡正移,所以![]() 转化率增大,故A错误;
转化率增大,故A错误;
B.温度较低时,反应以合成二甲醚为主,正反应放热,升高温度,平衡逆移![]() 平衡转化率降低,故B正确;
平衡转化率降低,故B正确;
C.由图像可知,![]() 加氢合成二甲醚应该选择具有良好的低温活性的催化剂,故C正确;
加氢合成二甲醚应该选择具有良好的低温活性的催化剂,故C正确;
D.由图像可知,高温有利于逆水汽变换反应,而不利于二甲醚的生成,故D正确;
故答案选:BCD;
②由图二可知:随着压强升高,![]() 平衡转化率和二甲醚的选择性都增大,反应以生成二甲醚为主,压强升高反应正移二氧化碳转化率增大;故答案为:反应
平衡转化率和二甲醚的选择性都增大,反应以生成二甲醚为主,压强升高反应正移二氧化碳转化率增大;故答案为:反应![]() 为减压反应,随着压强升高反应正移,
为减压反应,随着压强升高反应正移,![]() 平衡转化率和二甲醚的选择性都增大;
平衡转化率和二甲醚的选择性都增大;
(5)由图可知氢碳比![]() 在3~6之间二甲醚的选择性较大,反应主要以生成二甲醚为主,可提高产物的纯度,二氧化碳转化率随着氢碳比
在3~6之间二甲醚的选择性较大,反应主要以生成二甲醚为主,可提高产物的纯度,二氧化碳转化率随着氢碳比![]() 的增大而增大,提高原料的利用率,故答案为:可提高产物的纯度,提高原料的利用率。
的增大而增大,提高原料的利用率,故答案为:可提高产物的纯度,提高原料的利用率。