题目内容
【题目】如图是“铁链状”图案,图中相连的两物质可归属于同一类别,相交部分A、B、C、D为其相应的分类依据代号。
![]()
(1)①写出相邻两种物质之间能发生反应的化学方程式______________________________
②写出除去NaCl溶液中杂质FeCl3的化学方程式__________________________。
(2)请简述选用图中物质制备Fe(OH)3胶体的实验操作_________________________。
(3)以下框图中化合物A是上述链状图中的一种物质,是生活中常见的一种调味品,如下图是该物质在化工生产中的一系列反应;其中化合物F俗称烧碱,单质C也是上述链状图中的一种物质。
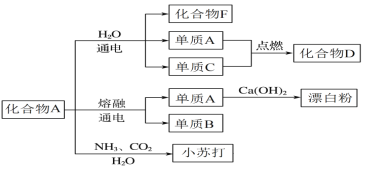
①写出单质B与H2O反应的离子方程式______________________________。
②单质A与Ca(OH)2反应制取漂白粉的化学方程式为 ________________________。
【答案】Na2O+CO2=Na2CO3 FeCl3+3NaOH=Fe(OH)3↓+3NaCl 将饱和FeCl3溶液,滴入沸水中,可得到Fe(OH)3胶体 2Na+2H2O=2Na++2OH-+H2↑ 2Cl2+2 Ca(OH)2=== CaCl2+Ca(ClO)2+2H2O
【解析】
(3)化合物A是生活中的调味品,故A是![]() ,化合物F俗称烧碱,故F是
,化合物F俗称烧碱,故F是![]() ,由转化关系图可知C是
,由转化关系图可知C是![]() ,A是
,A是![]() ,D是
,D是![]() 。
。
(1) 相邻两种物质之间能发生反应的应该为氧化钠与二氧化碳,其化学方程式为:①.![]() ;
;
②氯化铁可与氢氧化钠反应生成沉淀,据此可向NaCl溶液中加入适量氢氧化钠来除去杂质FeCl3,其化学方程式为:![]() ;
;
(2)将饱和FeCl3溶液,滴入沸水中,可得到Fe(OH)3胶体;
(3)化合物A是生活中的调味品故A是![]() ,化合物F俗称烧碱,故F是
,化合物F俗称烧碱,故F是![]() ,由转化关系图可知C是电解食盐水获得的单质,电解食盐水方程式为
,由转化关系图可知C是电解食盐水获得的单质,电解食盐水方程式为![]() ,电解熔融氯化钠方程式为
,电解熔融氯化钠方程式为![]() ,所以C是
,所以C是![]() ,A是
,A是![]() ,D是
,D是![]() ,
,
①,单质B为Na,其与水反应的离子方程式为:![]() ;
;
②单质A为氯气,与Ca(OH)2反应制取漂白粉的化学方程式为:![]() ;
;