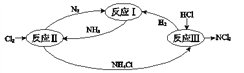
题目内容
【题目】R2O82-离子在一定条件下可以把Mn2+离子氧化,若反应后R2O82-离子变为RO42-离子,又知反应中氧化剂和还原剂的物质的量之比为5︰2,Mn2+离子被氧化后的化合价为
A. 4 B. 5 C. 6 D. 7
【答案】D
【解析】R2O82-中R元素的化合价是+7价,RO42-中R元素的化合价是+6价,则R元素化合价降低,R2O82-是氧化剂,所以Mn2+是还原剂,设Mn元素的化合价升高到+x价,则根据得失电子守恒有:5×(7-6)×2=2×(x-2),得x=7,故答案选D。

练习册系列答案
相关题目
【题目】已知在温度低于570 0C 时,还原铁粉与水蒸气反应的产物是FeO,高于570 0C时,生成Fe3O4。老师用上图所示实验装置,完成了还原铁粉与水蒸气反应的演示实验。
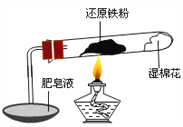
甲同学为探究实验后试管内的固体含有哪些物质,进行了下列实验:
实验编号 | 实验操作 | 实验现象 |
① | 取少量黑色粉末放入试管中,加入盐酸,微热 | 黑色粉末逐渐溶解,溶液呈浅绿色;有少量气泡产生 |
② | 向试管中滴加几滴KSCN溶液,振荡 | 溶液没有出现血红色 |
根据上述实验,下列说法不正确的是( )
A. 试管内的固体一定含有铁粉
B. 试管内的固体一定不含有Fe3O4
C. 不能确定试管内的固体一定含有FeO
D. 可通过将试管内固体彻底还原,分析其质量减小的方法来确定是否含有Fe3O4