题目内容
已知:H2O(g)===H2O(l) ΔH=—Q1 kJ·mol-1
C2H5OH(g)===C2H5OH(l) ΔH=—Q2 kJ·mol-1
C2H5OH(g)+3O2(g)===2CO2(g)+3H2O(g) ΔH=—Q3 kJ·mol-1
若使46 g液态酒精完全燃烧,最后恢复到室温,则放出的热量为( )
C2H5OH(g)===C2H5OH(l) ΔH=—Q2 kJ·mol-1
C2H5OH(g)+3O2(g)===2CO2(g)+3H2O(g) ΔH=—Q3 kJ·mol-1
若使46 g液态酒精完全燃烧,最后恢复到室温,则放出的热量为( )
| A.(Q1+Q2+Q3) kJ | B.(Q2—3Q1—Q3) kJ |
| C.(0.5Q1-1.5Q2+0.5Q3) kJ | D.(3Q1-Q2+Q3) kJ |
D
根据盖斯定律可知,将①H2O(g)===H2O(l)、②C2H5OH(g)===C2H5OH(l)和③C2H5OH(g)+3O2(g)===2CO2(g)+3H2O(g)叠加,即①×3+③-②得到C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(l),所以△H=-(3Q1-Q2+Q3) kJ /mol,46g液态酒精是1mol,所以答案是D。

练习册系列答案
相关题目
 HBr+H的能量对反应历程的示意图,下列叙述中正确的是( )
HBr+H的能量对反应历程的示意图,下列叙述中正确的是( )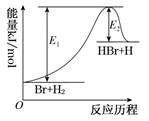
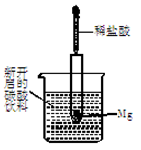
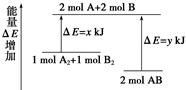
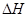 的绝对值均正确)
的绝对值均正确)