题目内容
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是
A. 42gC3H6中含有的共用电子对数目为8NA
B. 由6gCaCO3和5gKHCO3组成的混合物中含有的碳原子数为0.11NA
C. 标准状况下,22.4L氯气和56g铁充分反应,转移的电子数为3NA
D. 1L0.01mol·L-1Kal(SO4)2溶液中含有的阳离子数为0.02NA
【答案】B
【解析】A、C3H6电子式为: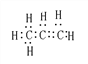 ,42g C3H6物质的量=42g÷42g/mol=1mol,所以电子对数目为9NA,故A错误;B项,CaCO3、KHCO3的摩尔质量均为100g/mol,6gCaCO3为0.06mol,含碳原子数为0.06NA,5gKHCO3为0.05mol,含碳原子数为0.05NA,所以混合物中含碳原子数为0.11NA,故B正确;C项,标准状况下,22.4L氯气为1mol,56g铁为1mol,由反应2Fe+3Cl2
,42g C3H6物质的量=42g÷42g/mol=1mol,所以电子对数目为9NA,故A错误;B项,CaCO3、KHCO3的摩尔质量均为100g/mol,6gCaCO3为0.06mol,含碳原子数为0.06NA,5gKHCO3为0.05mol,含碳原子数为0.05NA,所以混合物中含碳原子数为0.11NA,故B正确;C项,标准状况下,22.4L氯气为1mol,56g铁为1mol,由反应2Fe+3Cl2![]() 2FeCl3可得,氯气不足,铁剩余,所以转移的电子数为2NA,故C错误;D项,因为KAl(SO4)2溶液中,存在着Al3+的水解,所以1L0.01mol·L-1KAl(SO4)2溶液中含有的阳离子数小于0.02NA,故D错误。综上,选B。
2FeCl3可得,氯气不足,铁剩余,所以转移的电子数为2NA,故C错误;D项,因为KAl(SO4)2溶液中,存在着Al3+的水解,所以1L0.01mol·L-1KAl(SO4)2溶液中含有的阳离子数小于0.02NA,故D错误。综上,选B。

练习册系列答案
相关题目
【题目】下列鉴别浓硫酸和稀硫酸的操作与结论有误的是( )
操作 | 结论 | |
A | 分别加入金属铝片 | 产生刺激性气味者为浓硫酸 |
B | 分别加入到盛水的试管中 | 剧烈放热者为浓硫酸 |
C | 取等体积样品,称量质量 | 质量大者为浓硫酸 |
D | 分别滴在火柴梗上 | 变黑者为浓硫酸 |
A. A B. B C. C D. D