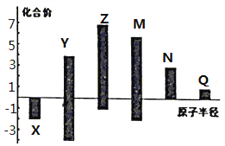
题目内容
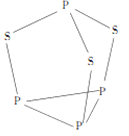
【题目】三硫化四磷是黄绿色针状结晶,其结构如图所示。不溶于冷水,溶于叠氮酸、二硫化碳、苯等有机溶剂,在沸腾的NaOH稀溶液中会迅速水解。回答下列问题:
(1)Se是S的下一周期同主族元素,其核外电子排布式为____________。
(2)第一电离能:S______(填“>”、“<”或“=”,下同)P,电负性:S_____P。
(3)三硫化四磷分子中P原子采取_________杂化,与PO3-互为等电子体的化合物分子的化学式为_______。
(4)二硫化碳属于________(填“极性”或“非极性”)分子。
(5)用NA表示阿伏伽德罗常数的数值,0.1mol三硫化四磷分子中含有的孤电子对数为_________。
(6)叠氮酸(HN3)在常温下是一种液体,沸点较高,为308.8K,主要原因是_____________。
(7)氢氧化钠具有NaCl型结构,其晶胞中Na+与OH-之间的距离为αcm,晶胞中Na+的配位数为______,用NA表示阿伏加德罗常数的数值,NaOH的密度为_______g·cm-3。
【答案】 [Ar]3d104s24p4(或1s22s22p63s23p63d104s24p4) < > 3p3 SO3 非极性 NA HN3分子间存在氢键 6 ![]()
【解析】
(1)由题意Se为34号元素,位于第4周期第ⅥA族,其核外电子排布式为1s22s22p63s23p63d104s24p4。
(2)同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,第IIA和第IIIA族、第VA和第VIA族反常,P的最外层电子轨道为半充满状态,较稳定,难以失去电子,第一电离能较大,因此第一电离能S<P;同一周期元素中,元素的电负性随着原子序数的增大而增大,因此电负性:S>P。
(3)由图,三硫化四磷分子中与P原子相连的有3个原子,P原子上含有1个孤电子对,采取sp3杂化,根据等电子原理:由短周期元素组成的微粒,只要其原子总数相同、各微粒的价电子总数相同,则互称为等电子体,所以与PO3-互为等电子体的化合物为SO3。
(4)二硫化碳的分子结构与二氧化碳类似,碳原子采取sp杂化,是直线型分子,属于非极性分子。
(5)根据三硫化四磷的分子结构,每个P原子含有1个孤电子对,每个硫原子含有2个孤电子对,所以三硫化四磷分子中含有10个孤电子对,故用NA表示阿伏加德罗常数的值,0.1mol三硫化四磷分子中含有的孤电子对数为NA。
(6)N的电负性较大,HN3分子间存在氢键,所以沸点较高。
(7)NaCl晶胞如图所示 ,属于立方面心,因为氢氧化钠具有NaCl型结构,以Na+为体心分析,与之相邻的OH-位于面心,晶胞中Na+的配位数为6;因为晶胞中Na+与OH-之间的距离为a cm,所以晶胞棱长为2acm,晶胞体积为(2a cm)3=8a3 cm3,晶胞中Na+离子数目为1+12×
,属于立方面心,因为氢氧化钠具有NaCl型结构,以Na+为体心分析,与之相邻的OH-位于面心,晶胞中Na+的配位数为6;因为晶胞中Na+与OH-之间的距离为a cm,所以晶胞棱长为2acm,晶胞体积为(2a cm)3=8a3 cm3,晶胞中Na+离子数目为1+12×![]() =4、OH-离子数目为8×
=4、OH-离子数目为8×![]() +6×
+6×![]() =4,所以晶胞质量为4×
=4,所以晶胞质量为4×![]() g,故晶胞密度为:4×
g,故晶胞密度为:4×![]() g÷8a3 cm3=
g÷8a3 cm3=![]() g·cm-3。
g·cm-3。

 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案