题目内容
【题目】下列各反应中,水作还原剂的是( )
A.2H2+O2 ![]() 2H2O
2H2O
B.2F2+2H2O═4HF+O2
C.SO3+H2O═H2SO4
D.2Na+2H2O═2NaOH+H2↑
【答案】B
【解析】A.2H2+O2 ![]() 2H2O中,水为生成物,则水不是还原剂,A不符合题意;
2H2O中,水为生成物,则水不是还原剂,A不符合题意;
B.2F2+2H2O═4HF+O2中,水中O元素的化合价升高,则水作还原剂,B符合题意;
C.SO3+H2O═H2SO4中,各元素的化合价没有变化,则不属于氧化还原反应,水为反应物,C不符合题意;
D.2Na+2H2O═2NaOH+H2↑中,水中H元素的化合价降低,则水为氧化剂,D不符合题意;
故答案为:B.
氧化还原反应概念的判断。A.水为生成物,则水不是还原剂;B.水中O元素的化合价升高,则水作还原剂;C.各元素的化合价没有变化,则不属于氧化还原反应;D.水中H元素的化合价降低,则水为氧化剂。

【题目】分析下表中各项的排布规律,按此规律排布第30项应为( )
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
C2H4 | C2H6 | C2H6O | C2H4O2 | C3H6 | C3H8 | C3H8O | C3H6O2 | C4H8 | C4H10 |
A. C8H18 B. C8H16O2 C. C9H20 D. C9H20O
【题目】常温下有下列四种溶液:
① | ② | ③ | ④ | |
溶液 | pH=4的NH4Cl | pH=4的盐酸 | 0.1molL﹣1的醋酸 | 0.1molL﹣1的NaOH |
已知该温度下醋酸的电离平稀常数Ka=1.8×10﹣5 . 请回答下列问题:
(1)用④的标准液滴定③宜选用(填“石蕊”、“酚酞”或“甲基橙”)作为指示剂;①②溶液中由水电离出的c(H+)之比为 .
(2)将②③④三种溶液分别加水稀释10倍,pH变化最小的是(用序号表示),用pH试纸测定溶液pH的操作方法是 .
(3)都是0.1mol/L的①NH4Cl、②NH4HCO3、③CH3COONH4、④NH4HSO4的溶液中NH4+离子浓度大小顺序为 . (用序号填写)
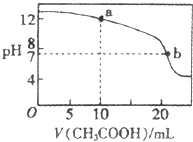
(4)取适量溶液③滴定20mL溶液④,滴定曲线如图所示,则a点时溶液中各离子浓度的大小关系为 . 若b点时消耗③的体积为V mL,则V20(填“>”、“<”或“=”).